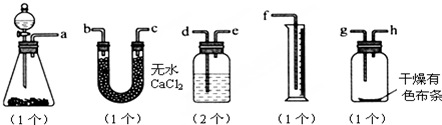
题目内容
5.(1)请写出:①Al与盐酸反应的离子方程式2Al+6H+=2Al3++3H2↑;
②Al与NaOH溶液反应的离子反应方程式2Al+2H2O+2OH-=2AlO2-+3H2↑.
(2)将AlCl3溶液加入试管中,为了将其中的Al3+离子全部沉淀,我们应加入(填“氨水”或“NaOH溶液”)氨水,写出其反应的离子方程式:Al3++3NH3.H2O=Al(OH)3↓+3NH4+
将所得沉淀分成两支试管,在一支试管中加入盐酸,在另一支试管中加入NaOH溶液,结果是两支试管中的沉淀都溶解了,说明Al(OH)3是一种两性氢氧化物.写出向AlCl3 溶液中滴加过量的NaOH溶液所发生反应的离子反应方程式:Al3++4OH-=AlO2-+2H2O.
分析 (1)①Al与盐酸反应生成氯化铝和氢气;
②Al与NaOH溶液反应,生成偏铝酸钠和氢气;
(2)将其中的Al3+离子全部沉淀,因氢氧化铝能溶于强碱,应选弱碱;向AlCl3 溶液中滴加过量的NaOH溶液,反应生成偏铝酸钠和NaCl和水.
解答 解:(1)①Al与盐酸反应生成氯化铝和氢气,离子反应为2Al+6H+=2Al3++3H2↑,故答案为:2Al+6H+=2Al3++3H2↑;
②Al与NaOH溶液反应,生成偏铝酸钠和氢气,离子反应为2Al+2H2O+2OH-=2AlO2-+3H2↑,故答案为:2Al+2H2O+2OH-=2AlO2-+3H2↑;
(2)将其中的Al3+离子全部沉淀,因氢氧化铝能溶于强碱,应选弱碱,即选择氨水,离子反应为Al3++3NH3.H2O=Al(OH)3↓+3NH4+;向AlCl3 溶液中滴加过量的NaOH溶液,反应生成偏铝酸钠和NaCl和水,离子反应为Al3++4OH-=AlO2-+2H2O,故答案为:氨水;Al3++3NH3.H2O=Al(OH)3↓+3NH4+;Al3++4OH-=AlO2-+2H2O.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应的离子反应考查,题目难度不大.

练习册系列答案
相关题目
16.用NA代表阿伏加德罗常数的值,下列有关说法正确的是( )
| A. | 78g过氧化钠晶体中,含2NA个阴离子 | |
| B. | 1L 0.1 mol/L醋酸溶液中含有的氢离子数为0.1NA | |
| C. | 在O2参与的反应中,1 mol O2作氧化剂时得到的电子数一定是4NA | |
| D. | 常温下16g O2与O3的混合气体中含氧原子数为NA |
13.短周期主族元素X、Y、A、B、C在元素周期表的位置如图所示,A是电负性最大的元素,则下列说法错误的是
( )
( )
| X | A | ||
| Y | C | B |
| A. | 元素原子半径大小顺序为:A<B<C<Y | |
| B. | 最高价含氧酸的酸性强弱顺序为:H2YO3<H2XO3 | |
| C. | A、B两种元素气态氢化物的沸点高低顺序为:HA<HB | |
| D. | B、C简单离子的还原性强弱顺序为:B-<C2- |
17.下列有关煤和石油的加工方法的叙述中错误的是( )
| A. | 通过煤的直接或间接液化可以获得各种芳香烃 | |
| B. | 通过石油的催化重整等工艺可获取芳香烃 | |
| C. | 石油的裂化的目的主要是为了提高轻质油的产量 | |
| D. | 石油通过常压分馏可以得到石油气、汽油、煤油、柴油等 |
14..能正确表示下列反应的离子方程式的是( )
| A. | 钠和冷水反应 2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 石灰石与醋酸溶液反应 CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 溴化亚铁溶液中通入少量氯气2Br-+Cl2═Br2+2C1- | |
| D. | NH4HCO3溶液中加入足量的NaOH溶液:NH+4+OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O |
15.氯离子:①具有酸性 ②有酸味 ③遇水见光放出氧气 ④比氯原子少一个电子 ⑤比氯原子多一个电子 ⑥呈黄绿色 ⑦呈无色 ⑧有咸味 ⑨可以失去电子 ⑩能使淀粉-碘化钾试纸变蓝.说法一定正确的是( )
| A. | ⑤⑦⑨ | B. | ①⑤⑦⑨⑩ | C. | ①②③④⑥⑨ | D. | ③⑤⑥⑧⑨ |