题目内容
【题目】下列关于化学反应速率的说法正确的是( )
A.化学反应速率是指在一段时间内任何一种反应物物质的量浓度的减少或任何一种生成物物质的量浓度的增加
B.化学反应速率可以衡量化学反应进行的快慢
C.化学反应速率为![]() 是指在某1s时的速率是
是指在某1s时的速率是![]()
D.对于任何化学反应来说,反应速率越快,反应现象越明显
【答案】B
【解析】
A.不能用固体和纯液体的物质的量浓度的变化来描述化学反应速率,A错误;
B.化学反应速率是指表示化学反应进行的快慢,通常以单位时间内反应物或生成物浓度的变化值(减少值或增加值)来表示,B正确;
C.化学反应速率是一个时间段内的平均反应速率,而不是某一个时刻的瞬时速率,C错误;
D.有些化学反应是没有明显反应现象的,D错误;
故答案为:B。

 亮点激活精编提优100分大试卷系列答案
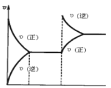
亮点激活精编提优100分大试卷系列答案【题目】下列实验中,对应的操作、现象以及所得出的结论都正确的是( )
选项 | 实验 | 现象 | 结论 |
A. | 把铝箔插入浓硝酸中 | 有大量红棕色气体产生 | 浓硝酸具有强氧化性 |
B. |
| 品红褪色 |
|
C. | 淀粉在酸催化水解后的溶液加入新制 | 无砖红色沉淀 | 淀粉水解产物不含葡萄糖 |
D. | 将充满 | 红棕色变深 | 反应 |
A.AB.BC.CD.D
【题目】用氯化铁浸出一重铬酸钾(K2Cr2O7)滴定法测定钛精粉试样中单质铁的质量分数[ω(Fe)%],实验步骤如下:
步骤1:称取试样0.100g于250mL洗净的锥形瓶中。
步骤2:加入FeCl3溶液100mL,迅速塞上胶塞,用电磁搅拌器搅拌30min。
步骤3:过滤,用水洗涤锥形瓶和滤渣各3~4次,洗液全部并入滤液中。
步骤4:将滤液稀释至500mL,再移取100mL稀释液于锥形瓶中,加入20mL硫酸和磷酸的混合酸,加0.5%二苯胺磺酸钠指示剂4滴。
步骤5:以K2Cr2O7标准溶液滴定至出现明显紫色为终点。发生的反应:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
步骤6:重复测定两次,数据如下:
第一次 | 第二次 | 第三次 | |
消耗的K2Cr2O7标准溶液体积(mL) | 10.01 | 9.99 | 13.00 |
步骤7:数据处理。
(1)步骤2中加入FeCl3溶液后锥形瓶中发生反应的离子方程式为___,迅速塞上胶塞的原因是___。
(2)步骤3中判断滤纸上残渣已洗净的方法是___。
(3)实验中需用到100mL浓度约为0.01mol·L-1K2Cr2O7标准溶液,配制时用到的玻璃仪器有___;称量K2Cr2O7固体前应先将其烘干至恒重,若未烘干,对测定结果的影响是___(填“偏高”、“偏低”或“无影响”);滴定时,K2Cr2O7溶液应置于___(填仪器名称)中。
(4)利用上表数据,计算出该钛精粉试样中单质铁的质量分数为___(写出必要的计算过程)。