题目内容
【题目】化学电池在通讯、交通及日常生活中有着广泛的应用。
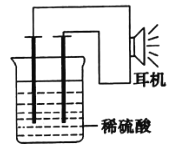
(1)锌锰干电池是应用最普遍的电池之一,如图为锌锰干电池的构造示意图,锌锰干电池的负极材料是________(填物质名称),负极发生的电极反应为_____________。若反应消耗32.5 g负极材料,则电池中转移电子的数目为________。

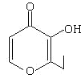
(2)目前常用的镍镉(Ni-Cd)可充电电池的总反应式可表示为Cd+2NiO(OH)![]() 2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,以下说法正确的是________(填序号)。
2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,以下说法正确的是________(填序号)。
①该电池可以在酸性条件下进行充、放电
②该电池放电时,负极的电极反应式为Cd-2e-+2OH-=Cd(OH)2
③该电池放电时,Cd极的质量减少
④该电池放电时,化学能转变为电能
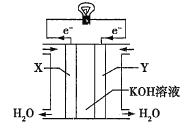
(3)如图为氢氧燃料电池的构造示意图,电解质溶液是KOH溶液。则X极为电池的________(填“正”或“负”)极,X极的电极反应式为_________。
【答案】锌 Zn-2e-=Zn2+ 6.02×1023 ②④ 负 H2-2e-+2OH-=2H2O
【解析】
(1)负极上锌失电子发生氧化反应;先计算Zn的物质的量,然后根据Zn是+2价的金属计算Zn转移电子的物质的量;
(2)该电池放电时为原电池,充电时为电解池,放电时能自发进行,充电时需要外加电源;
(3)燃料电池中,通入燃料的电极是负极、通入氧化剂的电极为正极,该燃料电池中,Y电极上氧气得电子和水反应生成氢氧根离子。
(1)负极发生氧化反应,锌失去电子,电极反应式为Zn-2e-=Zn2+,32.5g锌的物质的量为n(Zn)=![]() =0.5 mol,而1 molZn反应失去2 mol电子,所以32.5 g锌参与反应时转移电子的物质的量为1 mol,转移的电子数目约为6.02×1023;
=0.5 mol,而1 molZn反应失去2 mol电子,所以32.5 g锌参与反应时转移电子的物质的量为1 mol,转移的电子数目约为6.02×1023;
(2)①根据电池反应原理可知,因为该电池在碱性条件下进行充、放电,①错误;
②因为电池在放电时,负极Cd失去电子,产生的Cd2+与OH-结合形成Cd(OH)2,电极反应式为:Cd-2e-+2OH-=Cd(OH)2,②正确;
③该电池放电时,Cd电极失去电子,发生氧化反应,电极反应式为:Cd-2e-+2OH-=Cd(OH)2,可见Cd电极的质量会增加,③错误;
④该电池放电时,是将化学能转化为电能,④正确;
故合理选项是②④;
(3)该燃料电池中,通入氢气的电极X为负极,由于电解质为KOH碱性环境,所以负极X上H2失去电子产生的H+与OH-结合形成H2O,故负极X的电极反应式为H2-2e-+2OH-=2H2O。

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案