题目内容
在2L密闭容器中,在一定条件下发生A(g)+3B(g) 2C(g),在10s内反应物A的浓度由1mol/L降到0.4mol/L,则ν(C)为
2C(g),在10s内反应物A的浓度由1mol/L降到0.4mol/L,则ν(C)为
A.0.06mol/(L·s) B.0.12mol/(L·s)
C.0.6mol/(L·s) D.1.2mol/(L·s)
B
解析试题分析:10s内反应物A的浓度减小了0.6mol/L,则C的浓度增加1.2mol/L,所以ν(C)=1.2mol/L/10s=0.12mol/(L·s),答案选B。
考点:考查化学反应速率的计算

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
对于可逆反应mA(g)十nB(g) pC(g)十qD(g),若其它条件都不变,探究催化剂对反应的影响,可得到如下两种v-t图象。下列判断正确的是
pC(g)十qD(g),若其它条件都不变,探究催化剂对反应的影响,可得到如下两种v-t图象。下列判断正确的是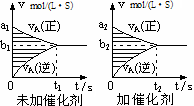
| A.b1>b2,t1>t2 |
| B.两图中阴影部分面积一定相等 |
| C.A的平衡转化率(II)大于(Ⅰ)中A的转化率 |
| D.若m+n<p+q,则压强变化对正反应速率的影响程度比逆反应速率影响程度大 |
用纯净的CaCO3与100 mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积),下列分析正确的是( )
| A.OE段表示的平均速率最快 |
| B.EF段,用盐酸表示该反应的平均反应速率为0.4 mol·L-1·min-1 |
| C.OE、EF、FG三段中,该反应用二氧化碳表示的平均反应速率之比为2∶6∶7 |
| D.F点收集到的CO2的量最多 |
下列说法正确的是( )
| A.Fe和Mg与0.1 mol·L-1的盐酸反应,反应速率相同 |
| B.0.1 mol·L-1的盐酸与0.1 mol·L-1H2SO4分别与大小、形状相同的大理石反应,反应速率相同 |
| C.催化剂能降低分子活化时所需能量,使单位体积内活化分子百分数大大增加 |
| D.100 mL 2 mol·L-1的盐酸与锌片反应,加入适量的NaCl溶液,反应速率不变 |
2SO2(g)+O2(g)  2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙、丁四个容积均为2 L的恒容密闭容器中投料,其起始物质的量及含硫反应物的平衡转化率如下表所示:
2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙、丁四个容积均为2 L的恒容密闭容器中投料,其起始物质的量及含硫反应物的平衡转化率如下表所示:
| | 甲 | 乙 | 丙 | 丁 | |
| 起始物质的量 | n(SO2)/mol | 0.40 | 0. 40 | 0.80 | 0 |
| n(O2)/mol | 0.24 | 0.48 | 0.48 | 0.04 | |
| n(SO3)/mol | 0 | 0 | 0 | 0.40 | |
| 含硫反应物的平衡转化率/% | 80 | α1 | α2 | α3 | |
下列判断中,正确的是( )
A.丁中SO3的平衡转化率为α3=80%
B.该温度下,平衡常数的值为400
C.平衡时,丙中c(SO3)是甲中的2倍
D.平衡时,甲中O2的转化率小于乙中O2的转化率
在一密闭容器中,用等物质的量的A和B发生如下反应:A(g)+2B(g) 2C(g),反应达到平衡时,若混合气体中A和B的物质的量之和与C的物质的量相等,则这时A的转化率为( )。
2C(g),反应达到平衡时,若混合气体中A和B的物质的量之和与C的物质的量相等,则这时A的转化率为( )。
| A.40% | B.50% | C.60% | D.70% |
 C(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是( )
C(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是( )
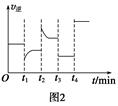
 xC(g) ΔH<0,B、C的物质的量随时间变化的关系如图1,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时间变化的关系如图2。下列有关说法正确的是( )
xC(g) ΔH<0,B、C的物质的量随时间变化的关系如图1,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时间变化的关系如图2。下列有关说法正确的是( )
 xC(g)+D(g)中,已知:反应开始加入的物质只有A、B,起始浓度A为5 mol·L-1,B为3 mol·L-1,前2 min C的平均反应速率为0.5 mol·L-1·min-1。2 min后,测得D的浓度为0.5 mol·L-1。则关于此反应的下列说法中正确的是( )
xC(g)+D(g)中,已知:反应开始加入的物质只有A、B,起始浓度A为5 mol·L-1,B为3 mol·L-1,前2 min C的平均反应速率为0.5 mol·L-1·min-1。2 min后,测得D的浓度为0.5 mol·L-1。则关于此反应的下列说法中正确的是( )