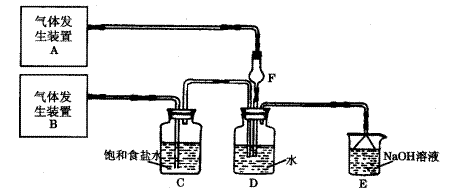
题目内容
工业碳酸钠由于在生产过程中原料盐和工艺等的原因,常会含有Na2SO4、NaCl中的一种或两种杂质。现有工业碳酸钠样品,某化学兴趣小组就工业碳酸钠中是否含有这两种杂质进行探究。 实验室有以下的仪器和药品可供使用:
实验室有以下的仪器和药品可供使用:
烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹:1.0 mol·L-1H2SO4、1.0 mol·L-1HNO3、1.0mol·L-1HCl、NaOH稀溶液、0.1 mol·L-1AgNO3、0.1 mol·L-1BaCl2、0.1 mol·LBa(NO3)2、蒸馏水。以下是部分实验探究过程:
1)提出假设:
假设1 白色粉末为 的混合物;
假设2 白色粉末为 的混合物;
假设3 白色粉末为碳酸钠、硫酸钠、氯化钠的混合物;
2)基于假设设计实验方案
3)根据实验方案进行实验
 请回答:
请回答:
(1)某同学取少许样品于试管中,加适量蒸馏水溶解,向试管中滴入0.1 mol·L-1的BaCl2溶液,有白色沉淀产生,他认为样品中含有Na2SO4。你认为他的结论是 (填“对的”或“错的”),原因是: 。
(2)设计实验方案
基于工业碳酸钠中两种杂质均存在这一假设,设计出实验方案(在答题卡上作答)。
 实验室有以下的仪器和药品可供使用:
实验室有以下的仪器和药品可供使用:
烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹:1.0 mol·L-1H2SO4、1.0 mol·L-1HNO3、1.0mol·L-1HCl、NaOH稀溶液、0.1 mol·L-1AgNO3、0.1 mol·L-1BaCl2、0.1 mol·LBa(NO3)2、蒸馏水。以下是部分实验探究过程:

1)提出假设:
假设1 白色粉末为 的混合物;
假设2 白色粉末为 的混合物;
假设3 白色粉末为碳酸钠、硫酸钠、氯化钠的混合物;
2)基于假设设计实验方案
3)根据实验方案进行实验
 请回答:
请回答:(1)某同学取少许样品于试管中,加适量蒸馏水溶解,向试管中滴入0.1 mol·L-1的BaCl2溶液,有白色沉淀产生,他认为样品中含有Na2SO4。你认为他的结论是 (填“对的”或“错的”),原因是: 。
(2)设计实验方案

基于工业碳酸钠中两种杂质均存在这一假设,设计出实验方案(在答题卡上作答)。

| 编号 | 实验操作 | 预期现象和结论 |
| ① |   | 有无色气体产生,说明样品中含有Na2CO3。 若无气体产生,说明样品中没有Na2CO3。 |
| ② |   | |
| ③ |   | |
(1)3 (1分)1)假设1 碳酸钠、氯化钠;(1分)假设2 碳酸钠、硫酸钠(1分)
(1)错的(1分)。溶液中含有CO32—,可与BaCl2溶液产生BaCO3沉淀,因此无法确定该沉淀是BaSO4(2分)。
(3)(“实验操作” “预期现象和结论”共11分)
本题也 可参照下列答案给分:
可参照下列答案给分:
(1)错的(1分)。溶液中含有CO32—,可与BaCl2溶液产生BaCO3沉淀,因此无法确定该沉淀是BaSO4(2分)。
(3)(“实验操作” “预期现象和结论”共11分)
| 编号 | 实验操作 | 预期现象和结论 |
| ① | 取少许样品于试管1中( 1分),加蒸馏水溶解(1分)。向试管中加足量的1.0 mol·L-1HNO3(或加入1.0 mol·L-1HNO3至溶液中不再有气体放为止)(1分)。 | |
| ② | 向试管1中加入0.1 mol·L-1的Ba(NO3)2溶液(1分)。若有沉淀产生,则继续加入0.1 mol·L-1Ba(NO3)2至过量(1分)。 | 有白色沉淀产生,则含Na2SO4(1分)若无白色沉淀产生,则不含Na2SO4(1分) |
| ③ | 将试管1静置片刻后,取少量上层清液于试管2中(1分),加入0.1 mol·L-1AgNO3溶液。(1分) | 有白色沉淀产生,则含NaCl(1分)若无白色沉淀产生,则不含NaCl(1分) |
本题也
 可参照下列答案给分:
可参照下列答案给分:| 编号 | 实验操作 | 预期现象和结论 |
| ① | 取少许样品于烧杯中,加蒸馏水溶解(1分)。取烧杯中所得溶液少许于试管1中(1分),加入足量的1.0mol·L-1HCl(或加入1.0 mol·L-1HCl至溶液中不再有气体放为止)(1分)。 mol·L-1HCl至溶液中不再有气体放为止)(1分)。 | |
| ② | 向试管1中加入0.1 mol·L-1BaCl2溶液。 (1分) | 有白色沉淀产生,则含Na2SO4(1分)若无白色沉淀产生,则不含Na2SO4(1分) |
| ③ | 取烧杯中所得溶液少许于试管2中,向试管2中加入0.1 mol·L-1的Ba(NO3)2溶液(1分),若有沉淀产生,则继续加入0.1 mol·L-1Ba(NO3)2至过量(1分)。取少量上层清液于试管2中,加入0.1 mol·L-1AgNO3溶液。(1分) | 有白色沉淀产生,则含NaCl(1分)若无白色沉淀产生,则不含NaCl(1分) |
略

练习册系列答案
相关题目
 了探究二氧化硫的漂白作用到底是二氧化硫本身还是二氧化硫与水作用的产物,某学习小组设计了如下装置来进行实验。请回答相关问题。
了探究二氧化硫的漂白作用到底是二氧化硫本身还是二氧化硫与水作用的产物,某学习小组设计了如下装置来进行实验。请回答相关问题。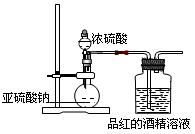
 3
3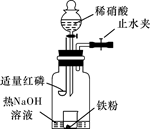
 则假设2正确;
则假设2正确;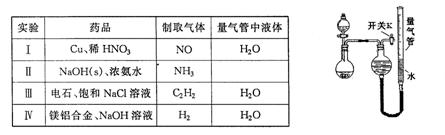
 .0mL
.0mL
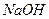 溶液来测定未知浓度的盐酸的浓度:
溶液来测定未知浓度的盐酸的浓度: