题目内容
【题目】下列物质间的转化,能通过一步反应实现的是
A. S→SO3 B. Fe→FeCl2 C. CuO→Cu(OH)2 D. SiO2→H2SiO3
【答案】B
【解析】A. S→SO2 →SO3,不能通过一步反应实现,故不选A;B. Fe+2HCl=FeCl2+H2↑,能通过一步反应实现,故选B;C. CuO→Cu2+→Cu(OH)2 ,不能通过一步反应实现,故不选C;D. SiO2→Na2SiO3→H2SiO3,不能通过一步反应实现,故不选D。

【题目】某校化学兴趣小组探究SO2的一些性质。
[探究一]:SO2能否被BaCl2溶液吸收。
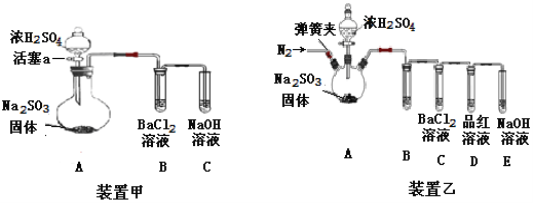
甲、乙两同学分别设计如下装置甲和装置乙进行探究
甲、乙两同学实验时观察到各仪器中的现象如下:
A | B | C | D | |
装置甲中的现象 | Na2SO3固体表面有气泡.瓶中白雾 | 白色沉淀 | ----- | ------ |
装置乙中的现象 | Na2SO3固体表面有气泡.瓶中白雾 | 有气泡 | 有气泡 | 品红褪色 |
回答下列问题:
(1)甲同学经过后续实验确证了B中白色沉淀是BaSO4.甲同学的后续实验操作是____
(2)乙同学分析装置甲中产生BaSO4的可能原因有:
①A中产生的白雾是硫酸的酸雾,进入B中与BaCl2溶液反应生成BaSO4沉淀。
②________________________(用离子方程式表示)。
(3)装置乙中B中所盛试剂是___;乙同学在滴加浓硫酸之前的操作是___________
(4)通过上述实验,得出的结论是________________________
[探究二]:SO2与FeCl3溶液的反应
查阅资料:①Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+;②生成Fe(HSO3)2+离子的反应为可逆反应。实验步骤为:
步骤I | 往5mL1mol·L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色。微热3 min,溶液颜色变为浅绿色。 |
步骤II | 往5mL重新配制的1mol·L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色。几分钟后,发现溶液颜色变成浅绿色。 |
回答下列问题:
(5)当SO2通入到FeCl3(未用盐酸酸化)溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象。将混合液放置12小时,溶液才变成浅绿色。则溶液由棕黄色变成红棕色的原因是_________;写出溶液由红棕色变为浅绿色时发生反应的离子方程式___________
(6)通过实验可知_____和________可缩短浅绿色出现的时间。
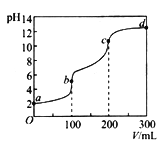
【题目】几种短周期元素的原子半径及主要化合价如下表:
元素符号 | A | B | C | D | E |
原子半径(nm) | 0.160 | 0.080 | X | 0.143 | 0.074 |
主要化合价 | +2 | +2 | -2,+4,+6 | +3 | -2 |
则X可能的数值为
A. 0.069 B. 0.102 C. 0.145 D. 0.184