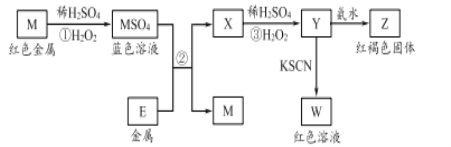
题目内容
【题目】活性炭、纯碱(Na2CO3)和小苏打(NaHCO3)在生产、生活中应用广泛。完成下列填空:
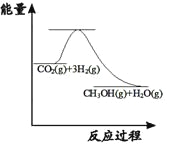
(1)活性炭可用于处理大气污染物NO:![]() ,已知NO的转化率随温度升高而降低。降低温度,重新达到平衡,判断下列各物理量的变化:(选填“增大”、“减小”或“不变”)
,已知NO的转化率随温度升高而降低。降低温度,重新达到平衡,判断下列各物理量的变化:(选填“增大”、“减小”或“不变”)![]() __________;N2的体积分数___________;平衡常数K____________。
__________;N2的体积分数___________;平衡常数K____________。
(2)将氨气和二氧化碳先后通入饱和食盐水中,可观察到的现象是_______;写出相关反应的化学方程式______________
(3)小苏打既能跟酸反应,又能跟碱反应,应用勒夏特列原理进行解释。_____________
(4)比较同温下浓度均为0.01mol/L的①H2CO3、②Na2CO3、③NaHCO3、④NH4HCO3四种溶液中![]() 的大小关系为_______(用编号表示)。
的大小关系为_______(用编号表示)。
【答案】减小 增大 增大 溶液中有白色沉淀生成 NH3+CO2+NaCl+H2O→NH4Cl+NaHCO3↓ 当NaHCO3溶液加入酸时,促进了HCO3-的水解,生成CO2;当加入碱时,促进了HCO3-的电离,生成碳酸正盐。 ②>③>④>①
【解析】
(1)NO的转化率随温度升高而降低,说明该反应为放热反应,则降低温度后平衡向着正向移动,反应速率减小、氮气体积分数和平衡常数都增大;
(2)氨气极易溶于水,饱和食盐水中先通入氨气再通入二氧化碳会析出碳酸氢钠晶体;
(3)碳酸氢钠在溶液中存在电离平衡HCO3- H++CO32-,水解平衡:HCO3-+H2OH2CO3+OH-;当加入酸时促进了HCO3-的水解;当加入碱时促进了HCO3-的电离;
(4) H2CO3为二元弱酸,分步电离,以第一步电离为主,溶液中c(CO32-)最小;Na2CO3在溶液中电离出碳酸根离子,碳酸根离子的水解程度较小,其溶液中c(CO32-)最大;NaHCO3在溶液中,碳酸氢根离子的水解程度大于其电离程度,溶液中碳酸根离子浓度较小;NH4HCO3溶液中,铵根离子水解溶液呈酸性,抑制了碳酸氢根离子的电离,据此进行解答。
(1)反应![]() 中,NO的转化率随温度升高而降低,说明升高温度平衡向着逆向移动,则该反应为放热反应;若降低温度,正逆反应速率都减小,平衡向着吸热的正反应进行,氮气的物质的量增大,则N2的体积分数增大;因为降低温度后氮气和二氧化碳的浓度增大,NO的浓度减小,则平衡常数增大;
中,NO的转化率随温度升高而降低,说明升高温度平衡向着逆向移动,则该反应为放热反应;若降低温度,正逆反应速率都减小,平衡向着吸热的正反应进行,氮气的物质的量增大,则N2的体积分数增大;因为降低温度后氮气和二氧化碳的浓度增大,NO的浓度减小,则平衡常数增大;
答案是:减小;增大;增大;
(2)将氨气和二氧化碳先后通入饱和食盐水中发生反应:NH3+CO2+NaCl+H2O=NH4Cl+NaHCO3↓;则溶液中会有白色沉淀生成;
答案是:溶液中有白色沉淀生成;NH3+CO2+NaCl+H2O=NH4Cl+NaHCO3↓;
(3)碳酸氢钠在溶液中存在电离平衡:HCO3-H++CO32-,水解平衡:HCO3-+H2OH2CO3+OH-;当NaHCO3溶液加入酸时,减小了c(OH-),促进了HCO3-的水解,生成CO2;当加入碱时,减小了c(H+),促进了HCO3-的电离,抑制了HCO3-的水解,生成了碳酸正盐;
答案是:当NaHCO3溶液加入酸时,促进了HCO3-的水解,生成CO2;当加入碱时,促进了HCO3-的电离,生成碳酸正盐;
(4)③④相比较,④中铵根离子水解呈酸性,抑制了碳酸氢根离子的电离,c(CO32-)大小为:③>④;①为二元弱酸,c(CO32-)最小;②Na2CO3在溶液中电离出钠离子和碳酸根离子,碳酸根离子水解程度较小,则其溶液中c(CO32-)最大,所以c(CO32-)的大小关系为: Na2CO3> NaHCO3> NH4HCO3> H2CO3,即: ②>③>④>①;
答案是: ②>③>④>①。

 名校课堂系列答案
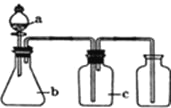
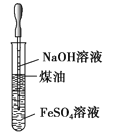
名校课堂系列答案【题目】下表中a、b、c表示相应仪器中加入的试剂,可用如图装置制取、净化、收集的气体是( )
编号 | 气体 | a | b | c |
|
A | NH3 | 浓氨水 | 碱石灰 | 碱石灰 | |
B | CO2 | 盐酸 | 碳酸钙 | 饱和NaHCO3溶液 | |
C | NO | 稀硝酸 | 铜屑 | H2O | |
D | Cl2 | 浓盐酸 | 二氧化锰 | 饱和NaCl溶液 |
A.AB.BC.CD.D