题目内容
3.向100mL18mol•L-1的硫酸中加入足量的铜片并加热,则被还原的硫酸的物质的量是( )| A. | 等于0.9mol | B. | 大于0.9mol、小于1.8mol | ||
| C. | 等于1.8mol | D. | 小于0.9mol |
分析 铜与浓硫酸加热时发生反应,随着反应的进行,浓硫酸的浓度逐渐减小,当成为稀硫酸是此反应停止,由此分析解答.
解答 解:100ml 18mol/L的硫酸中n(H2SO4)=18mol/L×0.1L=1.8mol,假设100ml 18mol/L的硫酸中的硫酸分子全部与铜反应时,据Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O可知作氧化剂的硫酸为0.9mol,起酸作用的硫酸0.9mol,随着反应的进行,浓硫酸溶液的浓度逐渐减小,当成为稀硫酸是此反应停止,所以作氧化剂的硫酸的物质的量小于0.9mol,即被还原的硫酸的物质的量小于0.9mol,
故选:D.
点评 此题考查铜与浓硫酸的反应,易错点为错把1.8mol硫酸全部当成氧化剂,错认为1.8mol硫酸全部反应完全.

练习册系列答案
相关题目
13.下列物质中既含有离子键又含有共价键的化合物是( )
| A. | NaCl | B. | N2 | C. | KOH | D. | SO2 |
14.下列说法中,正确的是( )
| A. | 苯、乙烯都能被酸性KMnO4溶液氧化 | |
| B. | 煤的干馏和石油的分馏原理相同,都是化学变化 | |
| C. | 从苯的凯库勒式看,分子中含有双键,所以苯属于烯烃 | |
| D. | 乙醇分子中的化学键如图,在Cu等催化作用下和O2反应,①③处断裂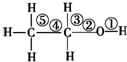 |
11.下列离子方程式中,书写正确的是( )
| A. | 碳酸氢钠溶液中加入过量的石灰水:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| B. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | 用碳酸钠溶液吸收足量二氧化硫:2CO32-+2SO2+H2O═2HCO3-+SO32- | |
| D. | 在FeBr2溶液中通入足量的Cl2气体:3Cl2+2Fe2++4Br-═6Cl-+2Fe3++2Br2 |
18.载人宇宙飞船中用太阳能电池和氢氧燃料电池进行供电.下列相关说法错误的是( )
| A. | 制造太阳能电池的材料是单质硅 | |
| B. | 太阳能电池将光能转化为化学能 | |
| C. | 氢氧燃料电池中氢气在负极反应 | |
| D. | 碱性氢氧燃料电池中正极区有OH?生成 |
15.用下列实验装置进行相应实验,能达到实验目的是(夹持装置未画出)( )
| A. | 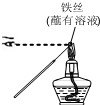 检验溶液中是否有K+ | B. | 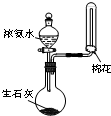 制取并收集少量NH3 | ||
| C. | 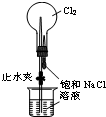 进行喷泉实验 | D. |  加热熔融NaOH固体 |
12.已知Cl2、Br2、FeCl3、I2的氧化性依次减弱.下列反应不可能发生的是( )
| A. | Cl2+2H Br=2HCl+Br2 | B. | Cl2+FeI2=FeCl2+I2 | ||
| C. | 3Cl2+6FeI2=2FeCl3+4FeI3 | D. | 2Fe3++2I-=2Fe2++I2 |