题目内容
如右图所示,此装置可用来制取和观察Fe(OH)2在空气中被氧化的颜色变化。实验时必须使用铁屑和6mol?L―1的硫酸。其他试剂任选。填写下列空白:
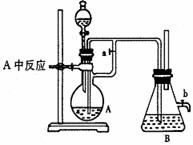
(1)B中盛有一定的NaOH,A中应预先加入的是 。A中反应的离子方程式是 。
(2)实验开始时应先将活塞a (填“打开”或“关闭”)
(3)简述生成Fe(OH)2的操作过程: 。
(4)实验完毕,打开b处活塞,放入一部分空气,此时B瓶中观察到的现象为 。
⑴铁屑 Fe + 2H+ = Fe2++H2↑
⑵打开 ⑶关闭活塞a ,使FeSO4 溶液压入B中进行反应
⑷ 4Fe(OH)2 + 2H2O +O2 = 4Fe(OH)3

练习册系列答案
相关题目
 (2012?河西区一模)碳和碳的化合物在生产、生活中的应用非常广泛,此方面的科学研究为当今提倡的“低碳生活方式”提供依据.请按要求回答下列问题:
(2012?河西区一模)碳和碳的化合物在生产、生活中的应用非常广泛,此方面的科学研究为当今提倡的“低碳生活方式”提供依据.请按要求回答下列问题: