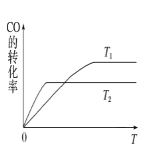
题目内容
【题目】金属钼(Mo)常用于工业、军事等领域,已被多个国家列为战略金属,我国的钼储量居世界第二。回答下列问题
(1)Mo与Cr是同族元素,并且位于相邻周期,写出基态Mo原子的价电子的轨道表达式为_____________。
(2)辉钼(MoS2)在纳米电子设备制造领域比硅或富勒烯(如C60)更有优势,可用H2S硫化(NH4)2MoO4溶液生产辉钼。H2S分子VSEPR模型为____________,(NH4)2MoO4中所有元素的第一电离能由大到小的顺序为________________;MoS2纳米粒子具有类似于石墨的层状结构,具有优异的润滑性能,其原因是___________________________。
(3)碳酸钠作固硫剂并用氢还原辉钼矿的原理为MoS2+4H2+2Na2CO3![]() Mo+2CO+4H2O+2Na2S,分子或离子中的大π键可用符号
Mo+2CO+4H2O+2Na2S,分子或离子中的大π键可用符号![]() 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为![]() ),则碳酸钠中CO32-离子中的大π键应表示为________。
),则碳酸钠中CO32-离子中的大π键应表示为________。
(4)钼的一种配合物化学式为:Na3[Mo(CN)8]8H2O,其中除共价键、配位键以外还存在的作用力有_____________,其中配体离子中σ键与π键数目之比为_________。
(5)金属钼晶体中的原子堆积方式如图所示,这种堆积方式为_________堆积。若晶体钼的密度为ρg·cm-3,钼原子半径为r pm,NA表示阿伏加德罗常数的值,M表示钼的相对原子质量,则钼晶胞中原子的空间利用率为__________________(用含有ρ、r、NA、M的代数式表示)。

【答案】![]() 四面体形 N>O>H>Mo 层与层之间的范德华力较弱,外力作用下易发生滑动 Π46 离子键、氢键 1:2 体心立方堆积
四面体形 N>O>H>Mo 层与层之间的范德华力较弱,外力作用下易发生滑动 Π46 离子键、氢键 1:2 体心立方堆积 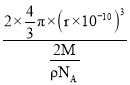
【解析】
(1)①Mo与Cr是同族元素,并且位于相邻周期,则Mo处于周期表中第五周期VIB族,价电子排布式4d55s1,价电子轨道排布图为:![]() ;
;
(2)H2S中心原子S原子价层电子对数为![]() =4,VSEPR模型为正四面体;一般金属性越强第一电离能越小,同周期主族元素随原子序数增大第一电离能呈增大趋势,N原子2p轨道为半充满稳定状态,第一电离能高于氧元素的,故第一电离能:N>O>H>Mo;具有类似于石墨的层状结构,层与层之间的范德华力较弱,在外力作用下容易发生滑动,具有优异的润滑性能;
=4,VSEPR模型为正四面体;一般金属性越强第一电离能越小,同周期主族元素随原子序数增大第一电离能呈增大趋势,N原子2p轨道为半充满稳定状态,第一电离能高于氧元素的,故第一电离能:N>O>H>Mo;具有类似于石墨的层状结构,层与层之间的范德华力较弱,在外力作用下容易发生滑动,具有优异的润滑性能;
(3)CO32-中,C原子为sp2杂化,空间构型为平面三角形,碳原子上有一个垂直于分子平面的p轨道;端位的3个氧原子也各有1个垂直于分子平面的p轨道,离子价电子总数为3×6+4+2=24,3个C-O键有6个电子,每个氧原子上有2对不与分子平面垂直的孤对电子对,因此4个平行p轨道中共有24-6-3×4=6个电子,所以CO32-离子中有1个4轨道6电子大π键,所以记为![]() ;
;
(4)还存在Na+与[Mo(CN)8]3-之间的离子键以及水分子之间的氢键;配体离子为CN-,碳氮之间为三键,含有1个σ键和2个π键,所以数目比为1:2;
(5)如图金属钼晶体中的原子堆积方式中,Mo原子处于立方体的体心与顶点,属于体心立方堆积;晶胞中Mo原子数目=1+8×![]() =2,故晶胞中Mo原子总体积=2×
=2,故晶胞中Mo原子总体积=2×![]() π×(r×10-10 cm)3,晶胞质量=
π×(r×10-10 cm)3,晶胞质量=![]() g,则晶胞体积=2×
g,则晶胞体积=2×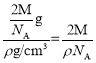 cm3,晶胞中原子的空间利用率=
cm3,晶胞中原子的空间利用率=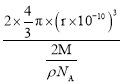 。
。

 阅读快车系列答案
阅读快车系列答案【题目】从下列事实所得出的相应结论正确的是
实验事实 | 结论 | |
A | 在相同温度下,向1 mL0.2 mol/LNaOH溶液中滴入2滴0.1 mol/LMgCl2溶液,产生白色沉淀后,再滴加2滴0.1 mol/LFeCl3溶液,又生成红褐色沉淀 | 溶解度:Mg(OH)2>Fe(OH)3 |
B | 某气体能使湿润的蓝色石蕊试纸变红 | 该气体水溶液一定显碱性 |
C | 同温同压下,等体积pH=3的HA和HB两种酸分别于足量的锌反应,排水法收集气体,HA放出的氢气多且反应速率快 | HB的酸性比HA强 |
D | SiO2既能与氢氟酸反应又能与碱反应 | SiO2是两性氧化物 |
A.AB.BC.CD.D