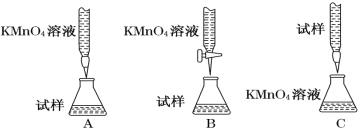
题目内容
【题目】(1)元素周期表分为 个横行,即 个周期,周期表中有 个纵行,共 个族。(每空1分)
(2)写出下列物质的电子式:①CO2 ;②NaOH 。(每空2分)
(3)下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:(离子方程式2分,其余每空1分)
主族 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
① 在这些元素中最活泼的非金属元素是 。
② 元素的最高价氧化物对应的水化物中酸性最强的是 ,碱性最强的是 。
③ 呈两性的氢氧化物是 ,其与③的最高价氧化物水化物反应的离子方程式为 。
④ 在③~⑦元素中,原子半径最大的是 。
【答案】(1) 7,7, 18, 16 (2)![]()
![]()
(3) ① F ② HClO4KOH ③ Al(OH)3Al(OH)3+OH-=AlO2-+ H2O ④ Na
【解析】试题分析:(1)元素周期表分为7个横行,即7个周期,周期表中有18个纵行,共16个族,包括7个主族、7个副族、一个0族和第Ⅷ族。
(2)①CO2是共价化合物,电子式为![]() ;
;
②NaOH是含有离子键和共价键的离子化合物,电子式为![]() 。
。
(3)根据元素在周期表中的位置可知①~⑩中元素分别是N、F、Na、Mg、Al、Si、Cl、Ar、K、Br。
①同周期自左向右非金属性逐渐增强,同主族自上而下非金属性逐渐减弱,则在这些元素中最活泼的非金属元素是F。
②非金属性越强,最高价含氧酸的酸性越强,F没有含氧酸,则元素的最高价氧化物对应的水化物中酸性最强的是HClO4;金属性最强的是K,则碱性最强的是KOH。
③呈两性的氢氧化物是Al(OH)3,其与③的最高价氧化物水化物氢氧化钠反应的离子方程式为Al(OH)3+OH-=AlO2-+ H2O。
④同周期自左向右原子半径逐渐减小,则在③~⑦元素中,原子半径最大的是Na。

 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案