题目内容
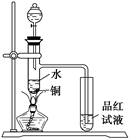
如图,在试管甲中先加入2 mL 95%的乙醇,在摇动情况下缓缓加入5 mL浓硫酸,并充分摇匀。冷却后再加入
(1)写出甲试管中的主要化学反应方程式:___________________________________________。
(2)加入浓硫酸的目的是__________________________________________________________。
(3)试管乙中观察到的现象是______________________________________________________。
(4)在实验中球形管除起冷凝作用外,另一个重要作用是__________________________,其原因是______________________________。
(5)饱和碳酸钠溶液的作用是____________________________。
(1)2CH3COONa+H2SO4![]() 2CH3COOH+Na2SO4
2CH3COOH+Na2SO4
CH3COOH+C2H5OH![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
(2)制取乙酸,作催化剂、吸水剂和脱水剂
(3)液体分层,上层为无色透明的油状液体,两层间有无色气泡产生
(4)防止倒吸 当液体上升到干燥管中,由于球形干燥管容积大,导致试管中液面明显下降,使导管末端脱离液面,干燥管中的液体又流回试管中,防止了倒吸
(5)中和蒸出的乙酸;溶解乙醇;降低乙酸乙酯在水中的溶解度,便于分层
解析:乙醇、浓H2SO4、CH3COONa反应生成CH3COOH与硫酸钠。CH3COOH、乙醇、浓H2SO4加热自然会发生酯化反应,故反应过程有2个,H2SO4的作用也应该是3个方面,即反应物、催化剂、吸水剂,装置图中把原来的长导管换成了干燥管,作用自然还是冷凝,与长导管的不同之处是干燥管插入液面以下,不会引起倒吸,而长导管不能插入液面以下,否则会引起倒吸。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 下面是某化学课外活动小组研究浓H2SO4的氧化性的结论并进行了实验验证:
下面是某化学课外活动小组研究浓H2SO4的氧化性的结论并进行了实验验证: