题目内容
X、Y是元素周期表第ⅦA族中的两种元素。下列叙述能说明X的非金属性比Y强的是
| A.X原子的电子层数比Y的多 |
| B.X的最高价含氧酸的酸性比Y的弱 |
| C.X的气态氢化物比Y的稳定 |
| D.Y的单质能将X从NaX的溶液中置换出来 |
C
试题分析:X原子的电子层数比Y的多,说明X的非金属性弱于Y的非金属性,A不正确;X的最高价含氧酸的酸性比Y的弱,说明X的非金属性弱于Y的非金属性,B不正确;非金属性越强,氢化物的稳定性越强,C正确;Y的单质能将X从NaX的溶液中置换出来,说明X的非金属性弱于Y的非金属性,D不正确,答案选C。
点评:该题是高考中的常见考点,属于中等难度的试题。试题基础性强,注重学生解题能力的培养。该题学生需要明确的是非金属性强弱比较的一般规律是,即①由元素原子的氧化性判断:一般情况下,氧化性越强,对应非金属性越强。②由单质和酸或者和水的反应程度判断:反应越剧烈,非金属性越强。③由对应氢化物的稳定性判断:氢化物越稳定,非金属性越强。④由和氢气化合的难易程度判断:化合越容易,非金属性越强。⑤由最高价氧化物对应水化物的酸性来判断:酸性越强,非金属越强。(除氟元素之外)。⑥由对应阴离子的还原性判断:还原性越强,对应非金属性越弱。⑦由置换反应判断:强置弱。〔若依据置换反应来说明元素的非金属性强弱,则非金属单质应做氧化剂,非金属单质做还原剂的置换反应不能作为比较非金属性强弱的依据〕。⑧按元素周期律,同周期元素由左到右,随核电荷数的增加,非金属性增强;同主族元素由上到下,随核电荷数的增加,非金属性减弱。⑨非金属单质与具有可变价金属的反应。能生成高价金属化合物的,其非金属性强。

练习册系列答案
相关题目
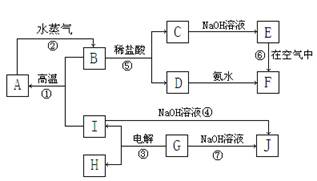
 填写下列空白:
填写下列空白:




 D的氯碱
D的氯碱