题目内容
【题目】(1)0.5 mol H2O的质量为 ____,其中含有_____个水分子,共有____个原子。
(2)质量都是50 g的 HCl、NH3、CO2、O2四种气体中,含有分子数目最少的是______,在相同温度和相同压强条件下,体积最大的是______,体积最小的是________。
(3)在_______mL 0.2 mol/L NaOH溶液中含1 g溶质;配制50 mL 0.2 mol/L CuSO4溶液,需要CuSO4·5H2O _________g。
【答案】 9g 3.01×1023 9.03×1023 CO2 NH3 CO2 125 2.5
【解析】(1)0.5 mol H2O的质量为0.5mol×18g/mol=9g,其中含有0.5mol×6.02×1023/mol=3.01×1023个水分子,共有0.5mol×3×6.02×1023/mol=9.03×1023个原子。(2)根据n=m/M可知质量相等时气体的相对分子质量越大,所含分子数越少。HCl、NH3、CO2、O2四种气体的相对分子质量分别是36.5、17、44、32,因此质量都是50 g的 HCl、NH3、CO2、O2四种气体中,含有分子数目最少的是CO2,在相同温度和相同压强条件下,体积与物质的量成正比,因此体积最大的是相对分子质量最小的氨气,体积最小的是 CO2。(3)1g氢氧化钠的物质的量是1/40mol,则需要0.2 mol/L NaOH溶液的体积为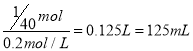 ;配制50 mL 0.2 mol/L CuSO4溶液,需要CuSO4·5H2O的质量为0.05L×0.2mol/L×250g/mol=2.5g。
;配制50 mL 0.2 mol/L CuSO4溶液,需要CuSO4·5H2O的质量为0.05L×0.2mol/L×250g/mol=2.5g。

练习册系列答案
相关题目