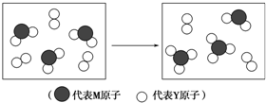
��Ŀ����
5��ij������Ͽ�����Al��Fe��Fe2O3��Al2O3��SiO2�еļ���������ɣ�Ϊ�ⶨ����ɼ���Ԫ�صĺ�����ȡ100.0g ��Ʒ��������ʵ�飺��֪����M�еμ�KSCN��Һ������������ ����NΪ���ʣ�H2���Ϊ��״���²�ã���ش�
��1����״����1.792L H2 �����ʵ�����0.08 mol��
��2������X��Y��ʵ����������ǹ��ˣ�
��3�����������X�м���ϡ���ᣬ����������ԭ��Ӧ�����ӷ���ʽ��Fe+2H+=Fe2++H2����2Fe3++Fe=3Fe2+��
��4��������ҺM�н��������ӵķ�����ȡ��Һ�������Թ��У�����Һ�еμ�KSCN��Һ��������������������ˮ����ͨCl2����˫��ˮ��������Һ��ɺ�ɫ��
��5������˵����ȷ����ac������ĸ����
a�����������һ������Al����һ������Al2O3
b��N������ϡ���ᷴӦ�ķ���ʽΪ��3Fe+8HNO3�T3Fe��NO3��2+2NO��+4H2O
c����M�еμ�NaOH��Һ��������ɫ��������̣����ձ�ɺ��ɫ����
��6�������������Ԫ�ص���������Ϊ22.4%��

���� ��1������n=$\frac{V}{Vm}$����1.792L H2 �����ʵ�����
��2�����ݷ����Һ�����IJ���������
��3��X�����к���Fe��Fe2O3�����ݶ���������ķ�Ӧ������
��4�����ݣ�3���ķ�Ӧ�ó�M�н���������Ϊ������������������ķ���Ϊ��ȡ��Һ�������Թ��У�����Һ�еμ�KSCN��Һ��������������������ˮ����ͨCl2����˫��ˮ��������Һ��ɺ�ɫ��
��5��a��������Ʒ���������Ʒ�Ӧ�������壬��˵��һ����������һ������Al2O3��
b��X�����к���Fe��Fe2O3�������ᷴӦ��ʣ��Ĺ���NΪFe��������ϡ���ᷴӦ������������
c����ҺMΪ�Ȼ�������
��6����Fe2O3Ϊxmol��FeΪymol������������������ᷴӦ��Fe������Fe2O3�����Fe3+��Ӧ��Fe���ڼ���W������ΪFe���������ټ���Fe2O3��Fe����������ΪFeԪ�ص����������������Ԫ�ص�����������
��� �⣺��1��n=$\frac{V}{Vm}$=$\frac{1.792L}{22.4L/mol}$=0.08 mol���ʴ�Ϊ��0.08mol��
��2��XΪ���壬YΪҺ�壬�����Һ�����IJ���Ϊ���ˣ��ʴ�Ϊ�����ˣ�
��3��ij�����������Fe��Fe2O3��Al2O3��SiO2�еļ���������ɣ�������������Һ���˵õ�����X����X�к���Fe��Fe2O3�����������ᷴӦ��Fe��HCl��Ӧ�����ӷ���ʽΪ��Fe+2H+=Fe2++H2����Fe2O3��HCl��Ӧ����Fe3+��Fe3+��Fe��Ӧ����Fe2+�������ӷ���ʽΪ2Fe3++Fe=3Fe2+��
�ʴ�Ϊ��Fe+2H+=Fe2++H2����2Fe3++Fe=3Fe2+��
��4�����ݣ�3���ķ�Ӧ�ó�M�н���������Ϊ������������������ķ���Ϊ��ȡ��Һ�������Թ��У�����Һ�еμ�KSCN��Һ��������������������ˮ����ͨCl2����˫��ˮ��������Һ��ɺ�ɫ���ʴ�Ϊ��������������������ˮ����ͨCl2����˫��ˮ��������Һ��ɺ�ɫ��
��5��a����Ϊ��Ʒ���������Ʒ�Ӧ�������壬����Ʒ��ֻ�������������Ʒ�Ӧ�������������������������Ʒ�Ӧ���������ɣ�����˵��һ����������һ������Al2O3����a��ȷ��
b��X�����к���Fe��Fe2O3�������ᷴӦ��ʣ��Ĺ���NΪFe��������ϡ���ᷴӦ����������������ʽΪ��Fe+4HNO3�TFe��NO3��3+NO��+2H2O����b����
c����ҺMΪ�Ȼ��������μ�NaOH��Һ�����������������İ�ɫ��������̣����ձ�ɺ��ɫ������������������c��ȷ��
�ʴ�Ϊ��ac��
��6����Fe2O3Ϊxmol��FeΪymol��n��H2��=$\frac{V}{Vm}$=$\frac{1.792L}{22.4L/mol}$=0.08 mol��
Fe2O3+6H+=2Fe3++3H2O��
x 2x
Fe+2H+=Fe2++H2����
0.08mol 0.08mol
2Fe3++Fe=3Fe2+��
2x x
��160x+56y=27.2g��0.08mol+x+$\frac{1.12}{56}$=y��
��ã�x=0.1��y=0.2��
�������������Ԫ�������ʵ���Ϊn��Fe��=0.1��2+0.2=0.04mol��m��Fe��=0.4mol��56g/mol=22.4g��
������Ԫ�ص���������Ϊ $\frac{22.4}{100.0}$��100%=22.4%��
�ʴ�Ϊ��22.4%��
���� ���⿼�������ʵķ�����������ӷ���ʽ����д�����ʺ����ļ���ȣ���Ŀ�����ڿ���ѧ�������������������ͼ�����������Ŀ�Ѷ��еȣ�

| A�� | ��ˮ | B�� | Na2SiO3��Һ | C�� | ŨHNO3 | D�� | FeSO4 |
| A�� | ���³�ѹ�£�22.4 L�������е��������ΪNA | |
| B�� | ���³�ѹ�£�18 gˮ���е�ԭ����Ϊ3NA | |
| C�� | 23g Na����������ȫȼ��ת�Ƶĵ�����Ϊ 2NA | |
| D�� | 0.3 mol/LNa2SO4��Һ�к���Na+����ĿΪ0.6NA |
| A�� | ��Ϊ��ɫ���� | B�� | ���Ⱦ��ֽ� | ||
| C�� | ��ˮ��Һ���Լ��� | D�� | ���������ᷴӦ |
| A�� | ��ϡ�����м�������������Һ��OH-+H+�TH2O | |
| B�� | ͭ��ϡ���ᷴӦ��Cu+2NO3-+4H+�TCu2++2NO2��+2H2O | |
| C�� | ���Ȼ�����Һ�м��������ˮ��Al3++3NH3•H2O�TAl��OH��3��+3NH4+ | |
| D�� | ���Ȼ�����Һ�м������ͭ��Fe3++Cu�TFe+Cu2+ |
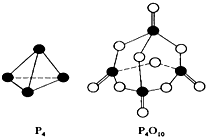 ������������ȼ�յķ�ӦΪ��P4+5O2�TP4O10����֪�������л�ѧ����Ҫ���յ������ֱ�Ϊ��P-P a kJ•mol-1��P-O b kJ•mol-1��P=O c kJ•mol-1��O=O d kJ•mol-1������ͼʾ�ķ��ӽṹ���й����������ƶ���ȷ���ǣ�������
������������ȼ�յķ�ӦΪ��P4+5O2�TP4O10����֪�������л�ѧ����Ҫ���յ������ֱ�Ϊ��P-P a kJ•mol-1��P-O b kJ•mol-1��P=O c kJ•mol-1��O=O d kJ•mol-1������ͼʾ�ķ��ӽṹ���й����������ƶ���ȷ���ǣ�������| A�� | 6a+5d��4c+10b | B�� | ��H=��4c+12b-6a-5d�� kJ•mol-1 | ||
| C�� | 6a+5d��4c+12b | D�� | ��H=��6a+5d-4c-12b�� kJ•mol-1 |
 ��
��