题目内容
4.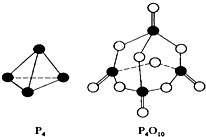 白磷在氧气中燃烧的反应为:P4+5O2═P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P a kJ•mol-1、P-O b kJ•mol-1、P=O c kJ•mol-1、O=O d kJ•mol-1.根据图示的分子结构和有关数据下列推断正确的是( )
白磷在氧气中燃烧的反应为:P4+5O2═P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P a kJ•mol-1、P-O b kJ•mol-1、P=O c kJ•mol-1、O=O d kJ•mol-1.根据图示的分子结构和有关数据下列推断正确的是( )| A. | 6a+5d<4c+10b | B. | △H=(4c+12b-6a-5d) kJ•mol-1 | ||
| C. | 6a+5d>4c+12b | D. | △H=(6a+5d-4c-12b) kJ•mol-1 |
分析 白磷分子为正四面体结构,每摩尔P4中含有6molP-P键,反应热△H=反应物总键能-生成物总键能,据此计算判断.
解答 解:白磷分子为正四面体结构,每摩尔P4中含有6molP-P键,白磷在氧气中燃烧涉及的各化学键键能为P-P a kJ•mol-1、P-O b kJ•mol-1、P=O c kJ•mol-1、O=O d kJ•mol-1.反应热△H=反应物总键能-生成物总键能,所以反应P4+5O2$\frac{\underline{\;点燃\;}}{\;}$P4O10的反应热△H=6akJ•mol-1+5dkJ•mol-1-(4ckJ•mol-1+12bkJ•mol-1)=(6a+5d-4c-12b)kJ•mol-1,
故选D.
点评 本题考查反应热与化学键键能的关系,题目难度中等,注意从物质能量、键能理解反应热,注意每摩尔P4中含有6molP-P键.

练习册系列答案
相关题目
15.下列关于同系物说法中正确的是( )
| A. | 符合同一通式的物质一定属于同系物 | |
| B. | 同系物的碳元素的质量分数一定相等 | |
| C. | 随碳原子数增加,烷烃的熔沸点逐渐升高 | |
| D. | 乙醇和HOCH2CH2CH2OH是同系物 |
12.做化学实验时,发生下列事故,处理方法不正确的是( )
| A. | 金属钠着火,用泡沫灭火器扑灭 | |
| B. | 实验台上的酒精灯碰翻着火,立即用湿抹布扑灭 | |
| C. | 皮肤溅上浓HNO3,立即用大量水冲洗,再用小苏打水洗涤 | |
| D. | 汞洒落地面,应立即用硫粉覆盖 |
9.下列用水就能鉴别的一组物质是( )
| A. | 己烷、四氯化碳 | B. | 汽油、己烷 | ||
| C. | 乙醇、乙酸 | D. | 1,2-二溴乙烷、四氯化碳 |
16.一种新型燃料电池,以镍板为电极插入KOH溶液中,分别向两极通乙烷和氧气,电极反应式为:C2H6+18OH--14e-═2CO32-+12H2O;7H2O+$\frac{7}{2}$O2+14e-═14OH-. 有关此电池的推断错误的是( )
| A. | 此燃料电池工作时,电解质溶液中的OH-向负极移动 | |
| B. | .参加反应的O2与C2H6的物质的量之比为7:2 | |
| C. | .电池工作一段时间后,KOH的物质的量浓度将下降 | |
| D. | .通氧气的电极为负极 |
13.下列物质中,属于共价化合物的是( )
| A. | O3 | B. | PCl3 | C. | Na2O2 | D. | NH4Cl |
14.下列反应对应的离子方程式正确的是( )
| A. | 用碳酸钙和稀盐酸反应制取CO2:CaCO3+2H+═CO2↑+H2O+Ca2+ | |
| B. | 金属钠与水的反应:Na+H2O═Na++OH-+H2↑ | |
| C. | 铝与氢氧化钠溶液反应:Al+2OH-═AlO2-+H2↑ | |
| D. | 将铁粉加入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ |