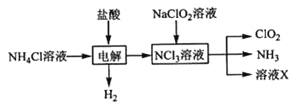
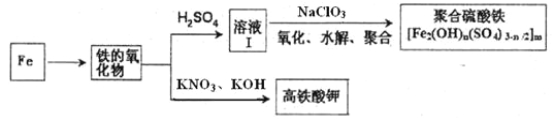
题目内容
【题目】将5.60 g铁投入100 mL某浓度的盐酸中,铁和盐酸恰好完全反应。
求:(1)5.60 g铁的物质的量
(2)所用盐酸中HCl中的物质的量浓度
(3)反应中生成的H2在标准状况下的体积
【答案】(1)0.1mol(2)1mol/L(3)2.24L
【解析】
试题分析:(1)n(Fe)=![]() =0.1mol,答:11.2g铁的物质的量为0.1mol;
=0.1mol,答:11.2g铁的物质的量为0.1mol;
(2)由反应Fe+2HCl=FeCl2+H2↑,n(HCl)=2n(Fe)=0.2mol,则c(HCl)=![]() =1mol/L,答:所用盐酸中HCl的物质的量浓度为1mol/L;
=1mol/L,答:所用盐酸中HCl的物质的量浓度为1mol/L;
(3)n(H2)=n(Fe)=0.1mol,标况下体积为0.1mol×22.4L/mol=2.24L,答:生成的H2在标准状况下的体积为2.24L。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】在相同温度下,体积均为1 L的四个密闭容器中,保持温度和容积不变,以四种不同的投料方式进行反应。平衡时有关数据如下(已知2SO2(g)+O2(g)![]() 2SO3(g)ΔH=-196.6 kJ·mol-1)。
2SO3(g)ΔH=-196.6 kJ·mol-1)。
容器 | 甲 | 乙 | 丙 | 丁 |
起始投料量 | 2 mol SO2+1 mol O2 | 1 mol SO2+0.5 mol O2 | 2 mol SO3 | 2 mol SO2+2 mol O2 |
反应放出或吸收的热量(kJ) | a | b | c | d |
平衡时c(SO3) (mol·L-1) | e | f | g | h |
下列关系正确的是( )
A.a=c;e=g B.a>2b;e>2f C.a>d;e>h D.c+98.3e>196.6