题目内容
某稀溶液中含4molKNO3和2.5molH2SO4,向其中加入1.5molFe粉,充分反应后产生的NO气体在标准状况下的体积为( )
| A.36L | B.28L | C.22.4L | D.11.2L |
B
解析试题分析:硝酸钾和硫酸混合相当于是稀硝酸,所以与加入的铁粉反应实质是铁与稀硝酸的反应,所以应该用离子方程式解题。
Fe + 4H+ + NO3- =Fe3++NO↑+2H2O
1 : 4 : 1 1
1.5mol 5mol 4mol n
所以从比例关系来看,只有H+ 完全反应,所以n(NO)=1/4n(H+)=1.25mol,所以转化为标况下体积V(NO)=28L,故选B。
考点:本题考查的是金属与酸的计算,用离子方程式解题。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
湿润的蓝色石蕊试纸接触氯气后,其颜色变化为
| A.变红 | B.先变红后变白 | C.变白 | D.不变 |
CuSO4是一种重要的化工原料,其有关制备途径如图所示。下列说法不正确的是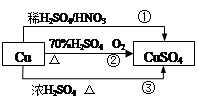
(已知:2Cu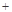 O2
O2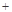 2H2SO4=2CuSO4
2H2SO4=2CuSO4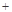 2H2O)
2H2O)
| A.相对于途径①、③,途径②更好地体现了绿色化学思想 |
| B.途径③中,1mol Cu与足量浓硫酸反应会产生64g SO2气体 |
C.途径①所用混酸中H2SO4与HNO3物质的量之比最好为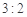 |
D.1mol Cu分别按照途径②、③中,被还原的H2SO4的质量之比为 |
常温下,往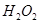 溶液中滴加少量
溶液中滴加少量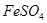 溶液,可发生如下两个反应:
溶液,可发生如下两个反应: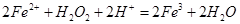 ,
,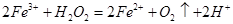 下列说法正确的是
下列说法正确的是
A.在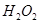 分解过程中, 分解过程中,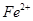 和 和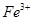 的总量保持不变 的总量保持不变 |
B.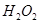 的氧化性比 的氧化性比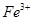 强,其还原性比 强,其还原性比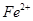 弱 弱 |
C.在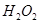 分解过程中,溶液的 分解过程中,溶液的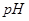 逐渐下降 逐渐下降 |
D.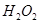 生产过程中加入少量 生产过程中加入少量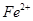 可以提高产率 可以提高产率 |
实验表明:将氯水滴加到一张蓝色石蕊试纸上,试纸上会出现如图所示的半径慢慢扩大的内外两个圆环,且两环颜色不同,下列有关说法中不正确的是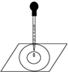
| A.此实验表明氯水具有酸性、漂白性 |
| B.内环呈白色外环呈红色或浅红 |
| C.内外环上颜色的差异表明此变化过程中,中和反应比氧化还原反应快 |
| D.氯水中形成次氯酸的反应中还原产物是HClO |
将51.2gCu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8mol,这些气体恰好能被500ml 2mol/LNaOH溶液完全吸收,生成含NaNO3和NaNO2的盐溶液,则原混合气体中NO的物质的量为 ( )
| A.0.3mol | B.0.4mol | C.0.5mol | D. 0.6mol |
在标准状况下,向100 mL氢硫酸溶液中通入二氧化硫气体,溶液pH变化如图所示,则原氢硫酸溶液的物质的量浓度为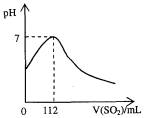
| A.0.5 mol/L | B.0.05 mol/L | C.1 mol/L | D.0.1 mol/L |
硫酸亚铁隔绝空气加强热分解形成四氧化三铁,将分解生成的气体通入氯化钡溶液中,下列叙述正确的是
| A.产生BaSO4沉淀 | B.产生BaSO3沉淀 |
| C.产生BaSO4与BaSO3的混合沉淀 | D.无沉淀产生 |
