题目内容
在标准状况下,向100 mL氢硫酸溶液中通入二氧化硫气体,溶液pH变化如图所示,则原氢硫酸溶液的物质的量浓度为
| A.0.5 mol/L | B.0.05 mol/L | C.1 mol/L | D.0.1 mol/L |
D
解析试题分析:标准状况下,向100mL氢硫酸溶液中通入二氧化硫,发生反应2H2S+SO2=3S↓+2H2O,溶液pH=7时,二氧化硫越硫化氢恰好反应,此时消耗二氧化硫112mL,二氧化硫的物质的量=0.112/22.4=0.005mol,根据方程式可知硫化氢的物质的量为0.005mol×2=0.01mol,则原氢硫酸溶液的物质的量浓度为0.1mol/L,故选D.
考点:本题考查了根据方程式进行的计算,难度不大,判断pH=7时二氧化硫与硫化氢恰好反应是关键,注意对基础知识的理解掌握

 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案SO2可用于工业制硫酸。下列关于SO2的性质描述不正确的是
| A.无色 | B.难溶于水 | C.密度比空气大 | D.有刺激性气味 |
欲验证某瓶中装的是氨水,现用一沾有浓盐酸的玻璃棒靠近瓶口,为了使现象明显,可先往瓶中加入一种物质,该物质可以选用下列物质中的( )
①浓H2SO4②固体烧碱③固体碳酸钙④生石灰⑤固体NH4Cl⑥固体食盐
| A.①② | B.②④⑤ | C.②③④⑤ | D.①③⑥ |
某稀溶液中含4molKNO3和2.5molH2SO4,向其中加入1.5molFe粉,充分反应后产生的NO气体在标准状况下的体积为( )
| A.36L | B.28L | C.22.4L | D.11.2L |
将35.8 g Al、Fe、Cu组成的合金溶于足量的NaOH溶液中,产生6.72 L气体(标准状况)。另取等质量的该合金溶于过量的稀硝酸中,生成13.44 LNO(标准状况),向反应后的溶液中加入足量的NaOH溶液,得到沉淀的质量为 ( )
| A.50.8 g | B.66.4 g | C.44.8g | D.39.2g |
氯气是一种有毒气体,在运输与贮存过程中必须防止泄漏。一旦储存液氯的钢瓶发生泄漏,必须立即采取措施,下列措施合理的是
| A.将人群向低处疏散 |
| B.将人群向顺风向疏散 |
| C.用浸有水或弱碱性溶液的毛巾捂住口鼻 |
| D.向泄漏地点撒一些氯化钠 |
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图),下列说法正确的是( )
A.洗气瓶中产生的沉淀是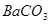 |
B.在Z导管出来的气体中无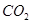 |
C.洗气瓶中产生的沉淀是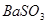 |
| D.在Z导管口有红棕色气体出现 |
下列有关双氧水说法错误的是
| A.H2O2、Na2O2都属于过氧化物,都存在共价键 |
| B.双氧水是绿色氧化剂,可作医疗消毒剂 |
| C.H2O2在过氧化氢酶的催化下,温度越高,分解速率越快 |
| D.H2O2做漂白剂是利用其氧化性,漂白原理与HClO类似,与SO2不同 |