题目内容
【题目】短周期元素W、X、Y和Z在周期表中的相对位置如图所示,下列叙述不正确的是
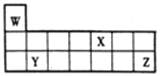
A. 原子半径:Y>Z>W
B. Z的氧化物对应的水化物酸性均比X的强
C. W、X、Z三种元素形成的化合物可能既含离子键又含共价键
D. 单质的熔点:Y>X>W
【答案】B
【解析】根据元素在周期表中的位置可知,W为H元素,X为N元素,Y为Mg元素,Z为Cl元素。A. 同周期从左到右,原子半径逐渐减小,同主族,从上到下,原子半径逐渐增大,原子半径:Y>Z>W,故A正确;B. Z的氧化物对应的水化物酸性不一定比X的强,如次氯酸为弱酸,硝酸为强酸,故B错误;C. W、X、Z三种元素形成的化合物可能既含离子键又含共价键,如硝酸铵,故C正确;D. 镁是固体金属,氮气和氢气均为气体,氮气的相对分子质量大于氢气,因此单质的熔点:Y>X>W,故D正确;故选B。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目