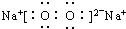��Ŀ����
���л�ѧ��Ӧ�����ӷ���ʽ��ȷ����
- A.��ϡ��ˮ��ͨ�����CO2��NH3?H2O+CO2=NH
 +HCO3
+HCO3
- B.��̼�������Һ�м�������������ƣ�Ca2++2HCO3-+2OH-�TCaCO3��+2H2O+CO32-
- C.��ϡHNO3��ҺFeS���壺FeS+2H+=Fe2++H2S��
- D.NH4HSO4��Һ�м�������Ba��OH��2��Һ��H++SO42-+Ba2++OH-�TBaSO4��+H2O
AB
������A����Ӧ����̼����泥�
B��̼�������ȫ��Ӧ������̼��ơ�̼���ơ�ˮ��
C������������ԭ��Ӧ������������S��NO��ˮ��
D��NH4HSO4��ȫ��Ӧ���������ᱵ��һˮ�ϰ���ˮ��
���A��ϡ��ˮ��ͨ�����CO2�����ӷ�ӦΪNH3?H2O+CO2=NH4++HCO3-����ѭ����غ㡢�����غ㶨�ɣ���A��ȷ��
B����̼�������Һ�м�������������Ƶ����ӷ�ӦΪCa2++2HCO3-+2OH-�TCaCO3��+2H2O+CO32-����B��ȷ��
C����ϡHNO3��ҺFeS��������ӷ�ӦΪFeS+NO3-+4H+=Fe3++2H2O+NO��+S����C����
D��NH4HSO4��Һ�м�������Ba��OH��2��Һ�����ӷ�ӦΪNH4++H++SO42-+Ba2++2OH-�TBaSO4��+H2O+NH3��H2O����D����
��ѡAB��
���������⿼�����ӷ�Ӧ����ʽ����д����Ϥ�����Ļ�ѧ��Ӧ�ǽ����Ĺؼ�����ע������غ㡢����غ㼰�����йص����ӷ�Ӧ����д�����������Ŀ�Ѷ��еȣ�
������A����Ӧ����̼����泥�
B��̼�������ȫ��Ӧ������̼��ơ�̼���ơ�ˮ��
C������������ԭ��Ӧ������������S��NO��ˮ��
D��NH4HSO4��ȫ��Ӧ���������ᱵ��һˮ�ϰ���ˮ��
���A��ϡ��ˮ��ͨ�����CO2�����ӷ�ӦΪNH3?H2O+CO2=NH4++HCO3-����ѭ����غ㡢�����غ㶨�ɣ���A��ȷ��
B����̼�������Һ�м�������������Ƶ����ӷ�ӦΪCa2++2HCO3-+2OH-�TCaCO3��+2H2O+CO32-����B��ȷ��
C����ϡHNO3��ҺFeS��������ӷ�ӦΪFeS+NO3-+4H+=Fe3++2H2O+NO��+S����C����
D��NH4HSO4��Һ�м�������Ba��OH��2��Һ�����ӷ�ӦΪNH4++H++SO42-+Ba2++2OH-�TBaSO4��+H2O+NH3��H2O����D����
��ѡAB��
���������⿼�����ӷ�Ӧ����ʽ����д����Ϥ�����Ļ�ѧ��Ӧ�ǽ����Ĺؼ�����ע������غ㡢����غ㼰�����йص����ӷ�Ӧ����д�����������Ŀ�Ѷ��еȣ�

��ϰ��ϵ�д�
�����Ŀ