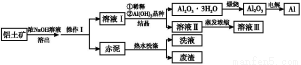
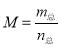题目内容
能说明0.1 mol·L-1的NaHA溶液一定呈酸性的是( )
①稀释时,溶液中c(OH-)增大
②溶液的pH<7
③溶液中c(Na+)=c(A2-)
④溶液可与等体积等物质的量浓度的NaOH溶液恰好反应
A.①②③④ B.①③④ C.①③ D.②④
C
【解析】酸性溶液稀释时,其c(H+)减小,因温度不变,KW不变,故c(OH-)增大,碱性溶液稀释时,其c(OH-)减小,因温度不变,KW不变,故c(H+)增大,中性溶液稀释时,其c(H+)=c(OH-),且不变,因此稀释时,溶液中c(OH-)增大,说明溶液呈酸性,①对;温度为100 ℃时,纯水的pH=6,溶液呈中性,此时pH<7的溶液不一定呈酸性,②错;溶液中c(Na+)=c(A2-),说明NaHA发生了完全电离:NaHA=Na++H++A2-,溶液呈酸性,③对;该物质为酸式盐,无论溶液呈酸性还是呈碱性,均可与等物质的量的NaOH反应生成对应的正盐,④错

人体血液里Ca2+离子的浓度一般采用mg/mL来表示。加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定,使草酸转化成CO2逸出。
试回答:
(1)现需要80 mL 0.02 mol·L-1标准KMnO4溶液来进行滴定,则配制溶液时需要的玻璃仪器有烧杯、玻璃棒和______________________;配制时, KMnO4溶液应用强酸酸化,本实验选择________作酸化剂。若选择HNO3酸化,则结果可能________(填“偏大”“偏小”或“不变”)。
(2)草酸与KMnO4反应的离子方程式为______________________________________
(3)滴定时,根据现象___________________________________
即可确定反应达到终点。
(4)滴定的实验数据如下所示:
实验编号 | 待测血液的体积/mL | 滴入KMnO4溶液的体积/mL |
1 | 20.00 | 11.95 |
2 | 20.00 | 13.00 |
3 | 20.00 | 12.05 |
经过计算,血液样品中Ca2+离子的浓度为________mg/mL。
(5)滴定的方法有酸碱中和滴定、沉淀滴定、络合滴定等。沉淀滴定所用的指示剂本身就是一种沉淀剂。以AgNO3标准溶液测定Cl-为例:
终点前:Ag++Cl-=AgCl (白色)
终点时:2Ag++CrO42—=Ag2CrO4(砖红色)
这是因为AgCl溶解度比Ag2CrO4更________的缘故。