题目内容
已知(CH3COOH)2(g) 2CH3COOH(g),经实验测得不同压强下,体系的平均摩尔质量(
2CH3COOH(g),经实验测得不同压强下,体系的平均摩尔质量(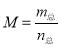 )随温度(T)的变化曲线如图所示,下列说法正确的是( )
)随温度(T)的变化曲线如图所示,下列说法正确的是( )
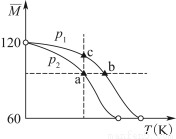
A.该过程的ΔH<0
B.气体压强:p(a)<p(b)=p(c)
C.平衡常数:K(a)=K(b)<K(c)
D.测定乙酸的相对分子质量要在高压、低温条件
B
【解析】由曲线看出,随温度升高平均相对分子质量减小,说明升高温度,平衡右移,为吸热反应,ΔH>0,A、D项错误;温度越高,平衡常数越大,故b点平衡常数最大,C项错误;图中曲线为等压线,p(b)=p(c),在同一温度下,压强越高,平均摩尔质量越大,即p(a)<p(c),故B项正确

碳及其化合物有广泛的用途。
(1)将水蒸气通过红热的碳即可产生水煤气。反应为
C(s)+H2O(g) CO(g)+H2(g) ΔH=+131.3 kJ·mol-1,
CO(g)+H2(g) ΔH=+131.3 kJ·mol-1,
以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2O的平衡转化率的是________。(填序号)
A.升高温度 B.增加碳的用量 C.加入催化剂 D.用CO吸收剂除去CO
(2)已知:C(s)+CO2(g) 2CO(g) ΔH=+172.5 kJ·mol-1,则CO(g)+H2O(g)
2CO(g) ΔH=+172.5 kJ·mol-1,则CO(g)+H2O(g) CO2(g)+H2(g)的焓变ΔH=________。
CO2(g)+H2(g)的焓变ΔH=________。
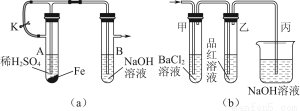
(3)CO与H2在一定条件下可反应生成甲醇:CO(g)+2H2(g) CH3OH(g)。甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨作电极,该电池负极反应式为__________________________________。
CH3OH(g)。甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨作电极,该电池负极反应式为__________________________________。
若用该电池提供的电能电解60 mL NaCl溶液,设有0.01 mol CH3OH完全放电,NaCl足量,且电解产生的Cl2全部逸出,电解前后忽略溶液体积的变化,则电解结束后所得溶液的pH=________。
(4)将一定量的CO(g)和H2O(g)分别通入到体积为2.0 L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g) CO2(g)+H2(g)。得到如下数据:
CO2(g)+H2(g)。得到如下数据:
温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | H2 | CO |
| |
900 | 1.0 | 2.0 | 0.4 | 1.6 | 3.0 |
通过计算求出该反应的平衡常数(结果保留两位有效数字)________。改变反应的某一条件,反应进行到t min时,测得混合气体中CO2的物质的量为0.6 mol。若用200 mL 5 mol/L的NaOH溶液将其完全吸收,反应的离子方程式为(用一个离子方程式表示)__________________________
(5)工业生产是把水煤气中的混合气体经过处理后获得的较纯H2用于合成氨。合成氨反应原理为N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如图甲所示。
2NH3(g) ΔH=-92.4 kJ·mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如图甲所示。
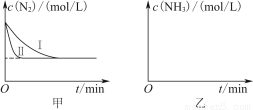
请回答下列问题:
①与实验Ⅰ比较,实验Ⅱ改变的条件为________________________________。
②实验Ⅲ比实验Ⅰ的温度要高,其他条件相同,请在图乙中画出实验Ⅰ和实验Ⅲ中NH3浓度随时间变化的示意图。
有一种白色粉末,含有下列阴离子和阳离子中的几种。
阴离子:S2-、Cl-、NO3—、SO42—、CO32—、HCO3—、MnO4—。
阳离子:Na+、Mg2+、Al3+、Ba2+、Fe2+、Fe3+、Cu2+、NH4+。
将该白色粉末进行下列实验,观察到的现象如下:
实验操作 | 现象 |
a.取少量粉末,加水、振荡 | 全部溶解、 |
溶液无色透明 |
|
b.向所得溶液中慢慢滴入苛性钠溶液,并加热 | 无明显现象 |
c.取少量粉末,加盐酸 | 无明显现象 |
d.取少量粉末,加稀H2SO4和稀HNO3的混合液 | 有白色沉淀生成 |
根据实验推断:
(1)从a实验中,可推断粉末中不可能有______________(填离子符号,下同)。
(2)从b实验中,可推断粉末中不可能有_____________________________________。
(3)从c实验中,可推断粉末中不可能有________________________________。
(4)从d实验中,可推断粉末中不可能有________,一定含有________。
(5)以上各实验仍无法确定是否存在的离子是____________。