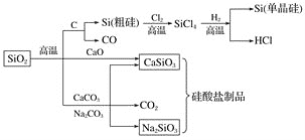
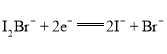题目内容
【题目】某探究学习小组测定加碘食盐中碘的含量,设计的实验步骤如下:
(1)准确称取wg食盐,加适量蒸馏水使其完全溶解;
(2)用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;请配平反应的方程式KIO3+KI+H2SO4=K2SO4+I2+H2O;______________
(3)生成的碘单质用Na2S2O3溶液滴定,反应的离子方程式为:I2+2S2O32-=2I-+S4O62-。滴定时,选择______________为指示剂,眼睛应该注视______________,达到滴定终点时的现象为______________,加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL时,恰好反应完全。
(4)该加碘食盐样品中的碘元素含量是______________mg/kg(以含w的代数式表示)。
(5)若记录标准液读数时,起始时仰视,终点时俯视,则所测结果会______________(填“偏高”、“偏低”或“无影响”)。
【答案】KIO3+5KI+3H2SO4===3K2SO4+3I2+3H2O 淀粉溶液 锥形瓶中溶液颜色的变化 溶液由蓝色变为无色,并且半分钟之内不变色 ![]() 偏低
偏低
【解析】
由题中信息可知,测定加碘食盐中碘的含量的原理是:称取一定质量的样品,加适量蒸馏水使其完全溶解,用稀硫酸酸化所得溶液,加入过量KI溶液,,使KIO3与KI反应完全,生成的碘单质用Na2S2O3溶液滴定,根据消耗Na2S2O3溶液的体积计算加碘食盐中碘的含量。
(1)准确称取wg食盐,加适量蒸馏水使其完全溶解;
(2)用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全,根据化合价升降的总数相等,配平该反应的化学方程式为KIO3+5KI+3H2SO4===3K2SO4+3I2+3H2O;
(3)生成的碘单质用Na2S2O3溶液滴定,反应的离子方程式为:I2+2S2O32-===2I-+S4O62-。滴定时,根据碘能使淀粉变蓝,可以选择淀粉溶液为指示剂,眼睛应该注视锥形瓶中溶液颜色的变化,达到滴定终点时的现象为:溶液由蓝色变为无色,并且半分钟之内不变色。
(4)加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL时,恰好反应完全,则消耗Na2S2O3的物质的量为2.0×10-3mol·L-110.0mL10-3L/mL=2.0×10-5mol,由上述两反应可得KIO3~3I2~6Na2S2O3,则n(KIO3)=![]() n(Na2S2O3)=
n(Na2S2O3)=![]() 2.0×10-5mol。该加碘食盐样品中的碘元素含量是
2.0×10-5mol。该加碘食盐样品中的碘元素含量是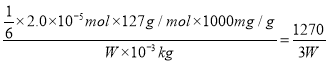 mg/kg。
mg/kg。
(5)若记录标准液读数时,起始时仰视,终点时俯视,则读取Na2S2O3溶液的体积偏小,导致所测结果会偏低。

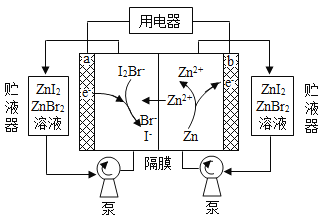
【题目】某化学兴趣小组在习题解析中看到:“SO2通入Ba(NO3)2溶液出现白色沉淀,是因为在酸性环境中,NO3-将SO32-氧化成SO42-而产生沉淀”。有同学对这个解析提出了质疑,“因没有隔绝空气,也许只是![]() 氧化了SO32-,与NO3-无关”。于是做了“SO2通入Ba(NO3)2溶液”的探究实验,用pH传感器检测反应的进行,实验装置如图。回答下列问题:
氧化了SO32-,与NO3-无关”。于是做了“SO2通入Ba(NO3)2溶液”的探究实验,用pH传感器检测反应的进行,实验装置如图。回答下列问题:

(1)仪器a的名称为__。
(2)实验小组发现装置C存在不足,不足之处是__。
(3)用0.1mol/LBaCl2溶液、0.1mol/LBa(NO3)2溶液、食用油,配制4种溶液(见下表)分别在装置C中进行探究实验。
编号 | ① | ② | ③ | ④ |
试剂 | 煮沸过的BaCl2溶液25mL,再加入食用油25mL | 未煮沸过的BaCl2溶液25mL | 煮沸过的Ba(NO3)2溶液25mL,再加入食用油25mL | 未煮沸过的Ba(NO3)2溶液25mL |
对比①、②号试剂,探究的目的是___。
(4)进行①号、③号实验前通氮气的目的是__。
(5)实验现象:①号依然澄清,②、③、④号均出现浑浊。第②号实验时C中反应的离子方程式为__。
(6)图1-4分别为①,②,③,④号实验所测pH随时间的变化曲线。
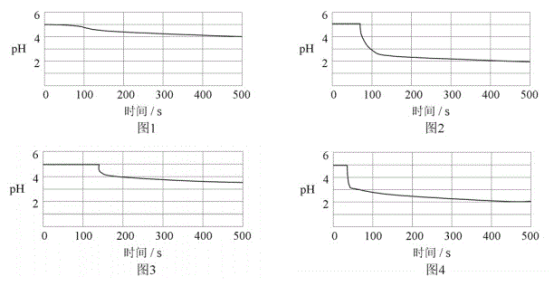
根据以上数据,可得到的结论是__。