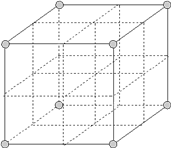
题目内容
【题目】下列说法错误的是
A. 在NH![]() 和[Cu(NH3)4]2+中都存在配位键
和[Cu(NH3)4]2+中都存在配位键
B.  σ键和π键比例为7:1
σ键和π键比例为7:1
C. C![]() 与O
与O![]() 互为等电子体,1 mol O
互为等电子体,1 mol O![]() 中含有的π键数目为2NA
中含有的π键数目为2NA
D. 已知反应N2O4(l)+2N2H4(l)===3N2(g)+4H2O(l),若该反应中有4 mol N—H键断裂,则形成的π键数目为3NA
【答案】B
【解析】分析:知道配位键的成因;根据结构式分析σ键和π键的数目;用等电子原理分析分子结构;了解常见分子的结构。
详解:A. NH3分子中的N有孤电子对,H+和Cu2+都有空轨道,故在NH![]() 和[Cu(NH3)4]2+中都存在配位键,A正确;
和[Cu(NH3)4]2+中都存在配位键,A正确;
B. 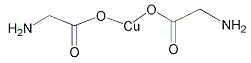 σ键和π键的数目分别为18和2,故其比例为9:1,B不正确;
σ键和π键的数目分别为18和2,故其比例为9:1,B不正确;
C. C![]() 与O
与O![]() 互为等电子体,故C
互为等电子体,故C![]() 与O
与O![]() 均含有叁键, 1 mol O
均含有叁键, 1 mol O![]() 中含有的π键数目为2NA,C正确;
中含有的π键数目为2NA,C正确;
D. N2分子中有叁键,叁键中有2个π键。已知反应N2O4(l)+2N2H4(l)===3N2(g)+4H2O(l),若该反应中有4 mol N—H键断裂,即消耗1mol N2H4,则生成1.5mol N2,形成的π键数目为3NA,D正确。
综上所述,说法错误的是B,本题选B。

【题目】氧族元素和卤族元素都能形成多种物质,我们可以利用所学物质结构的相关知识去认识和理解。
(1)H+可与H2O形成H3O+,H3O+ 立体构型为_________。H3O+中H﹣O﹣H键角比H2O中H﹣O﹣H键角大,原因为_________________________________________。
(2)COCl2的空间构型为____________;溴的价电子排布式为________________。
(3)根据已经掌握的共价键知识判断,键的极性F-H _______ O-H(“>”,“=”或“<”)
(4)溴化碘和水反应生成了一种三原子分子,该分子的结构式为____________________ ,中心原子杂化轨道类型为________________。
(5)根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是________。
氟 | 氯 | 溴 | 碘 | |
第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
(6)下列分子既不存在sp σ键,也不存在pp π键的是________。
A.HCl B.HF C.SO2 D.SCl2
(7)ClO2-立体构型为____________,写出与ClO2-互为等电子体的一种分子为______。
【题目】两份体积相同的某植物营养液,其配方分别如下:
KCl | K2SO4 | ZnSO4 | |
① | 0.3 mol·L-1 | 0.2 mol·L-1 | 0.1 mol·L-1 |
② | 0.1 mol·L-1 | 0.3 mol·L-1 | — |
下列对这两份营养液成分的分析中正确的是( )
A. K+的物质的量相同
B. Cl-的物质的量相同
C. 完全相同
D. SO![]() 的物质的量不同
的物质的量不同