题目内容
【题目】燃料电池型呼气酒精测试仪具有稳定性好,精度高,抗干扰性好等优点,是专门为警察设计的一款执法的检测工具,如图所示是一种酸性燃料电池酒精检测仪的示意图。下列说法错误的是( )
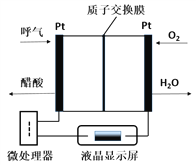
A. 该电池的负极反应式为:CH3CH2OH-4e-+H2O=CH3COOH+4H+
B. 当电路中有0.4mol电子转移时,消耗3.2gO2
C. 电池工作时H+从右向左通过质子交换膜
D. 微处理器通过检测电流大小可计算出被测气体中酒精的含量
【答案】C
【解析】A、该电池的负极上乙醇失电子发生氧化反应,分析装置图可知酒精在负极被氧气氧化发生氧化反应生成醋酸,负极反应式为CH3CH2OH-4e-+H2O=CH3COOH+4H+,A正确;B、乙醇燃料电池中,正极上是氧气得电子的还原反应,1mol氧气得到4mol电子,所以当电路中有0.4mol电子转移时,消耗0.1mol氧气,质量是3.2g,B正确;A、乙醇燃料电池中,负极上乙醇失电子发生氧化反应,正极上是氧气得电子的还原反应,电池工作时H+从左向右通过质子交换膜,C错误;D、根据微处理器通过检测电流大小可以得出电子转移的物质的量,根据电极反应式可以计算出被测气体中酒精的含量,D正确,答案选C。

【题目】碳及化合物在生产生活中用比较广泛。回答下列问题:
(1)已知:①H2(g)+ ![]() O2(g)=H2O(1)△H1=-285.8kJ·mol-1
O2(g)=H2O(1)△H1=-285.8kJ·mol-1
②CH3OH(1)+ ![]() O2(g)=CO2(g)+2H2O(1) △H2=-725.5kJ·mol-1
O2(g)=CO2(g)+2H2O(1) △H2=-725.5kJ·mol-1
则CO2(g)+3H2(g)=CH2OH(1)+H2O(1)的反应热 △H=____________。
(2)某研究小组用CO合成甲醇:CO(g)+2H2(g)![]() CH3OH(g)△H<0,将三组混合气体分别通入到三个2L恒容密闭容器中进行反应,得到如下三组实验数据:
CH3OH(g)△H<0,将三组混合气体分别通入到三个2L恒容密闭容器中进行反应,得到如下三组实验数据:
实验组 | 温度 | 起始时物质的量/mol | 平衡时物质的量/mol | 达到平衡所需的时间/min | ||||
CO | H2 | CH3OH | CO | H2 | CH3OH | |||
1 | 650 | 2.0 | 6.0 | 0 | 1.0 | 5 | ||
2 | 900 | 2.0 | 6.0 | 0 | 1.2 | 2 | ||
3 | 650 | 1.0 | 4.0 | 2.0 | a | b | c | t |
实验1条件下平衡常数K=__________,a、b之间可能的关系为_____________。
已知反应CO(g)+2H2(g)![]() CH3OH(g)中CO的转化率(a)与温度(T)、压强(p)的关系如右图所示:
CH3OH(g)中CO的转化率(a)与温度(T)、压强(p)的关系如右图所示:

①p1______p2(填“<”“>”“=”)。先升高温度、后增大压强,能否实现b点到c点的转化?__________(填“能”或“不能”),原因是_____________________________________________。
②a、c两点的反应速率为v1________v2(填“<”“>”“=”)。
③在不改变反应物用量情况下,为提高CO的转化率可采取的措施是_____________(答出三条措施)。

