题目内容
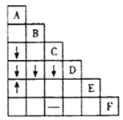
【题目】根据A-K在周期表中的位置(如图),回答下列问题:
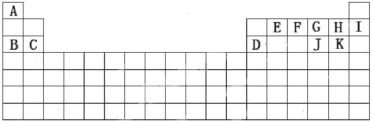
(1)最外层电子数是次外层电子数2倍的元素在周期表中的位置______________,化学性质最不活泼的元素是____________________(填化学符号或者化学式,下同)。
(2)E元素最高价氧化物的电子式____________________。
(3)D的最高价氧化物与K的最高价氧化物对应的水化物反应的离子方程式为_______________。
(4)A分别与F、G、H形成的简单化合物中,稳定性由强到弱的顺序为____________。
(5)C、D、G、H、J离子半径由大到小的顺序是___________________。
(6)用电子式表示化合物![]() 的形成过程:_________________________。
的形成过程:_________________________。
【答案】第二周期IVA族 Ne ![]() Al2O3+6H+=Al3++3H2O NH3<H2O<HF S2->O2->F->Mg2+>Al3+
Al2O3+6H+=Al3++3H2O NH3<H2O<HF S2->O2->F->Mg2+>Al3+ ![]()
【解析】
根据A-K在周期表中的位置可知,其所代表的元素分别为H、Na、Mg、Al、、C、N、O、F、Ne、S、Cl。
(1)最外层电子数是次外层电子数2倍的元素是6号的C元素,其他在周期表中的位置是第二周期IVA族;化学性质最不活泼的元素是稀有气体元素,表中给出的是Ne。
(2)E元素是C元素,其最高价氧化物二氧化碳是共价化合物,二氧化碳的电子式为![]() 。
。
(3)D的最高价氧化物为Al2O3,K的最高价氧化物对应的水化物为HClO4,HClO4是强酸,两者反应的离子方程式为Al2O3+6H+=Al3++3H2O。
(4)A分别与F、G、H形成的简单化合物分别为NH3、H2O、HF中,由于N、O、F的非金属性依次增强,故其稳定性由强到弱的顺序为NH3<H2O<HF。
(5)C、D、G、H、J离子分别为Mg2+、Al3+、O2-、F-、S2-,S2-的电子层数最多半径最大,其余的电子层结构相同的离子半径随着核电荷数的增大而减小,故半径由大到小的顺序是S2->O2->F->Mg2+>Al3+。
(6)![]() 是离子化合物,用电子式表示化合物
是离子化合物,用电子式表示化合物![]() 的形成过程为:
的形成过程为:![]() 。
。

 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案