题目内容
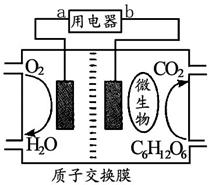
下图为一种新型的生物燃料电池,它有两个涂覆着酶的电极,处于充满空气和少量氢气的玻璃槽中,由于气 体可以混合从而省去了昂贵的燃料隔离膜。下列对其工作原理叙述正确的是
体可以混合从而省去了昂贵的燃料隔离膜。下列对其工作原理叙述正确的是

 体可以混合从而省去了昂贵的燃料隔离膜。下列对其工作原理叙述正确的是
体可以混合从而省去了昂贵的燃料隔离膜。下列对其工作原理叙述正确的是 
| A.该电池工作过程中,H+浓度不断增大 |
| B.该电池在高温环境下能提供更好的动力 |
| C.该电池负极反应为:H2—2e—=2H+ |
| D.该电池正极反应为O2+4e—=2O2- |
D
略

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 7N2+12 H2O可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
7N2+12 H2O可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。 2SO3(g) ΔH=—196.6 kJ·mol-1
2SO3(g) ΔH=—196.6 kJ·mol-1 。下列说法正确的是
。下列说法正确的是 
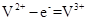
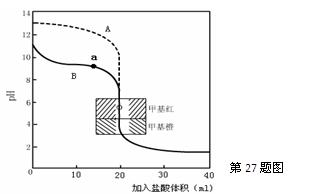
 ▲ ,通过计算所得的数据和简洁的文字说明电离常数、电离度与弱电解质的初始浓度的关系 ▲ 。
▲ ,通过计算所得的数据和简洁的文字说明电离常数、电离度与弱电解质的初始浓度的关系 ▲ 。