题目内容
9.在探究新制饱和氯水成分的实验中,下列根据实验现象与结论不正确的是( )| A. | 氯水的颜色呈浅黄绿色,说明氯水中含有Cl2 | |
| B. | 向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- | |
| C. | 向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ | |
| D. | 向紫色石蕊试液中滴加氯水,溶液最终变成白色,说明氯水中含有HClO |
分析 氯气溶于水,部分与氯气与水反应生成氯化氢和次氯酸,溶液中存在平衡Cl2+H2O?HCl+HClO,溶液中含有氯气、次氯酸、水三种分子,H+、ClO-、Cl-、OH-四种离子,只有氯气有颜色,为黄绿色,氯水中含有氯气而呈浅黄绿色,溶液中HCl与硝酸银反应产生AgCl白色沉淀,而溶液呈酸性,能与碳酸氢钠反应生成二氧化碳,溶液含有次氯酸具有漂白性,据此解答.
解答 解:氯气溶于水,部分与氯气与水反应生成氯化氢和次氯酸,溶液中存在平衡Cl2+H2O?HCl+HClO,溶液中含有氯气、次氯酸、水三种分子,H+、ClO-、Cl-、OH-四种离子,
A.氯水成分中,只有氯气为黄绿色,氯水的颜色呈浅黄绿色,说明氯水中含有Cl2,故A正确;
B.氯水中含有氯离子,能够与硝酸银反应生成氯化银沉淀,故B正确;
C.溶液呈酸性,能与碳酸氢钠反应生成二氧化碳,故C正确;
D.溶液含有次氯酸具有漂白性,所以最终溶液为无色,故D错误;
故选:D.
点评 本题考查了元素化合物知识,熟悉氯气与水的反应,明确氯水中含有的微粒及其性质是解题关键,题目难度不大,侧重考查学生对基础知识掌握的熟练程度.

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目
19.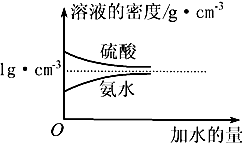 已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
(1)表中硫酸的质量分数w1为$\frac{98{c}_{1}}{1000{ρ}_{1}}$(不写单位,用含c1、ρ1的代数式表示).
(2)物质的量浓度为c1 mol•L-1,质量分数为w1的硫酸与水等质量混合,所得溶液的质量分数为$\frac{{w}_{1}}{2}$,物质的量浓度大于 c1/2mol•L-1(填“大于”、“小于”或“等于”,下同).
(3)质量分数为w2的氨水与3w2的氨水等质量混合,所得溶液的密度小于ρ2 g•cm-3.
 已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:| 溶质的物质的量浓度/mol•L-1 | 溶质的质量分数 | 溶液的密度/g•cm-3 | |
| 硫酸 | c1 | w1 | ρ1 |
| 氨水 | c2 | w2 | ρ2 |
(2)物质的量浓度为c1 mol•L-1,质量分数为w1的硫酸与水等质量混合,所得溶液的质量分数为$\frac{{w}_{1}}{2}$,物质的量浓度大于 c1/2mol•L-1(填“大于”、“小于”或“等于”,下同).
(3)质量分数为w2的氨水与3w2的氨水等质量混合,所得溶液的密度小于ρ2 g•cm-3.
17.下列物质中可以鉴别乙酸和乙醇的是( )
| A. | 金属钠 | B. | NaCl溶液 | C. | 水 | D. | 紫色石蕊试液 |
4.在强酸性溶液中能大量共存的离子组是( )
| A. | K+、Na+、NO3-、CO32- | B. | K+、Na+、Br-、SO32- | ||
| C. | K+、Na+、I-、SO42- | D. | Na+、K+、CH3COO-、SO42- |
1.能大量共存于同一溶液的离子组是( )
| A. | K+、H+、HCO3- | B. | Cu2+、Na+、OH- | C. | Na+、Cl-、NO3- | D. | Ag+、Cl-、SO42- |
18.向下列配合物的水溶液中加入AgNO3溶液,不能生成AgCl沉淀的是( )
| A. | [Co (NH3)6]Cl3 | B. | [Co (NH3)3Cl3] | C. | [Co (NH3)4Cl2]Cl | D. | [Co (NH3)5Cl]Cl2 |
19.下列说法正确的是( )
| A. | 正常雨水的pH值是7 | |
| B. | 冶炼金属钠用热分解法 | |
| C. | 使用过的塑料可以随意丢弃 | |
| D. | 治理水污染可以用混凝法、中和法、沉淀法等 |