题目内容
18.向下列配合物的水溶液中加入AgNO3溶液,不能生成AgCl沉淀的是( )| A. | [Co (NH3)6]Cl3 | B. | [Co (NH3)3Cl3] | C. | [Co (NH3)4Cl2]Cl | D. | [Co (NH3)5Cl]Cl2 |
分析 配合物中外界的氯离子能和银离子反应生成氯化银沉淀,而作为配位原子的氯原子不和银离子反应,据此分析解.
解答 解:A、[Co(NH3)6]Cl3中有阴离子氯离子,所以能和硝酸银反应生成氯化银沉淀,故A错误;
B、[Co(NH3)3Cl3]中没有阴离子氯离子,所以不能和硝酸银反应生成氯化银沉淀,故B正确;
C、[Co(NH3)4Cl2]Cl中有阴离子氯离子,所以能和硝酸银反应生成氯化银沉淀,故C错误;
D、[Co(NH3)4Cl2]Cl中有阴离子氯离子,所以能和硝酸银反应生成氯化银沉淀,故D错误;
故选B.
点评 本题考查了配合物中的成键情况,根据“配合物中阴离子能和银离子反应生成氯化银沉淀,配原子不和银离子反应”来分析解答即可,难度不大.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目
8.某研究性学习小组通过下列实验探究SO2能否与BaCl2溶液反应生成BaSO3沉淀,并制备硫酸铜晶体.完成下列填空.
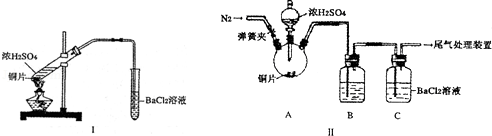
(Ⅰ)甲同学用装置I进行实验,加热反应物至沸腾,发现BaCl2溶液中出现白色沉淀,且白色沉淀不溶于盐酸.
白色沉淀是BaSO4.
甲同学就白色沉淀的生成原因提出了两种假设,这两种假设可能是:①浓硫酸沸腾蒸出进入氯化钡溶液生成沉淀;②SO2被氧气氧化成硫酸生成沉淀;
(Ⅱ)乙同学设计了改进装置Ⅱ进行实验,检验甲同学提出的假设(夹持装置和A中加热装置已略,气密性已检验).
①打开弹簧夹,通入N2一段时间后关闭弹簧夹;
②滴加一定量浓硫酸,加热A,一段时间后C中未见沉淀生成
回答下列问题
(1)操作①的目的是排除装置内的空气(O2),洗气瓶B中的试剂是饱和NaHSO3溶液.
(2)该实验能否检验甲同学上述两种假设中的任意一种不能,理由是因为同时改变了两个变量,无法确定到底是哪个变量的作用.
(Ⅲ)丙同学向反应后的蓝色溶液中加入足量的CuO,过滤后将滤液制成硫酸铜晶体(CuSO4•xH2O),采用加热法测定该晶体中结晶水x的值,实验数据记录如表:
(1)若无需再进行第三次称量,则a的数值范围应为18.621±0.001.
(2)若加热后坩埚与固体总质量为18.620g,计算x的实测值5.25(保留二位小数)

(Ⅰ)甲同学用装置I进行实验,加热反应物至沸腾,发现BaCl2溶液中出现白色沉淀,且白色沉淀不溶于盐酸.
白色沉淀是BaSO4.
甲同学就白色沉淀的生成原因提出了两种假设,这两种假设可能是:①浓硫酸沸腾蒸出进入氯化钡溶液生成沉淀;②SO2被氧气氧化成硫酸生成沉淀;
(Ⅱ)乙同学设计了改进装置Ⅱ进行实验,检验甲同学提出的假设(夹持装置和A中加热装置已略,气密性已检验).
①打开弹簧夹,通入N2一段时间后关闭弹簧夹;
②滴加一定量浓硫酸,加热A,一段时间后C中未见沉淀生成
回答下列问题
(1)操作①的目的是排除装置内的空气(O2),洗气瓶B中的试剂是饱和NaHSO3溶液.
(2)该实验能否检验甲同学上述两种假设中的任意一种不能,理由是因为同时改变了两个变量,无法确定到底是哪个变量的作用.
(Ⅲ)丙同学向反应后的蓝色溶液中加入足量的CuO,过滤后将滤液制成硫酸铜晶体(CuSO4•xH2O),采用加热法测定该晶体中结晶水x的值,实验数据记录如表:
| 坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 | |
| 第一次称量 | 第二次称量 | ||
| 11.710g | 22.700g | 18.621g | a |
(2)若加热后坩埚与固体总质量为18.620g,计算x的实测值5.25(保留二位小数)
9.在探究新制饱和氯水成分的实验中,下列根据实验现象与结论不正确的是( )
| A. | 氯水的颜色呈浅黄绿色,说明氯水中含有Cl2 | |
| B. | 向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- | |
| C. | 向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ | |
| D. | 向紫色石蕊试液中滴加氯水,溶液最终变成白色,说明氯水中含有HClO |
6.下列关于生活中常见药物的说法,不正确的是( )
| A. | “胃舒平”是治疗胃酸过多的药物 | |
| B. | “阿司匹林”是解热镇痛和消炎的药物 | |
| C. | “创可贴”是小伤口的外用消炎药物 | |
| D. | “风油精”是包治百病的药物 |
13.家用炒菜锅用水清洗后,出现红棕色的锈斑.此变化过程不发生的化学反应是( )
| A. | 4Fe(OH)2+2H2O+O2═4Fe(OH)3 | B. | 2Fe+2H2O+O2═2Fe(OH)2 | ||
| C. | 负极反应:Fe-3e-═Fe3+ | D. | 正极反应:2H2O+O2+4e--═4OH- |
3.下列叙述正确的是( )
| A. | 氯化钠溶液在电流作用下电离成钠离子和氯离子 | |
| B. | 溶于水后能电离出氢离子的化合物一定是酸 | |
| C. | 硫酸钡难溶于水,故硫酸钡不属于电解质 | |
| D. | 二氧化碳溶于水能导电,但二氧化碳不属于电解质 |
10.某晶体中含有极性共价键,关于该晶体说法错误的是( )
| A. | 不可能是离子晶体 | B. | 不可能是单质分子构成的晶体 | ||
| C. | 可能是分子晶体 | D. | 可能具有较高的熔沸点 |
7.实验中的下列操作正确的是( )
| A. | 用98%、1.84g/mL的浓硫酸配制1mol/L、500mL的稀硫酸时,应用量筒量取浓硫酸约27.17mL | |
| B. | 从碘水中萃取碘,如果没有四氯化碳和苯,其实也可以用酒精代替 | |
| C. | 用蒸发方法使NaCl 从溶液中析出时,应将蒸发皿中NaCl 溶液蒸干 | |
| D. | 从石蜡油中取用金属钠,发现取量过多,为了不浪费,又把过量的金属钠放回试剂瓶中 |