题目内容
【题目】0.1mol某元素M的单质直接与氯气反应后,消耗Cl23.55g,这种元素是( )
A. Na B. Mg C. Fe D. H2
【答案】A
【解析】参加反应的氯气的物质的量是3.55g÷71g/mol=0.05mol,得到电子的物质的量是0.05mol×2=0.1mol,这说明0.1molM的单质失去0.1mol电子,即元素M在反应中失去1个电子,化合价是+1价,因此该元素是Na或H,答案选A。

练习册系列答案
相关题目
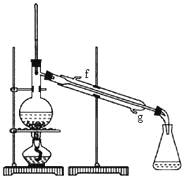
【题目】
反应原理:
反应物与产物的物理性质:
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | -103 | 83 | 难溶于水 |
(1)实验过程中可能发生的有机副反应的方程式为________________________________。
(2)根据上述资料,装置__________最适宜用来完成本次制备实验。



A B C
(3)制备粗产品
将5 mL________加入试管A中,再加入l0 mL_______,摇匀后放入碎瓷片,缓慢加热至反应完全。
(4)粗产品提纯
①环己烯粗产品中含有环己醇和少量酸性杂质等。粗产品需依次经过水洗,加碳酸钠溶液洗涤以及第二次水洗。在此过程中加入碳酸钠溶液的目的是_____________;分液时,环己烯应从分液漏斗的_____(填“上”或“下”)口取出。
②向水洗后的环己烯中加入少量的无水氯化钙,再将混合物放入右图所示装置的____________(填仪器名称)中,进行蒸馏,收集产品时,温度计显示的温度应为 。