题目内容
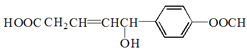
【题目】已知:乙二酸晶体熔点101.5℃;乙二酸晶体加热分解的方程式为:H2C2O42H2O![]() 3H2O + CO2↑+ CO↑。现利用下列装置验证反应产物中含有CO2和CO(装置不能重复使用)。请回答下列问题:
3H2O + CO2↑+ CO↑。现利用下列装置验证反应产物中含有CO2和CO(装置不能重复使用)。请回答下列问题:

(1)检验装置A气密性的方法是________________________________________________
(2)A装置是否有误_____________(填“是”或“否”),原因为_______________________
(3)按气流方向连接各仪器,用数字表示接口的连接顺序:①→_________________________;
(4)该套装置有明显缺陷,请予以更正________________________________________________
(5)证明CO存在的实验现象是_________________________________________________;
(6)根据题给的数据,假设反应产生的气体全部排出,并与吸收液充分反应(提示:B、C中澄清石灰水均先变浑浊,后又变澄清),最终D中生成了两种物质,则这两种生成物的化学式及对应的物质的量分别是①_______________,②_______________。
【答案】 连好装置,①处接长导管,将导管伸入盛有水的烧杯中,用手握住试管观察,若导管口产生连续气泡,松开手有小段水柱回流,则装置A气密性良好 否 乙二酸晶体分解之前先熔化,试管口必须朝上,否则液体会聚集在试管口 ⑤④⑥⑦②③ 缺少尾气处理装置,应在导管③后放置一个燃着的酒精灯(或用气囊收集) B装置中黑色氧化铜变红,澄清石灰水变浑浊,则含CO 0.01mol Na2CO3 0.08mol NaHCO3
【解析】(1)检查装置的气密性原理是根据装置内外的压强差形成水柱或气泡,所以检验装置气密性的方法是:连好装置,①处接长导管,将导管伸入盛有水的烧杯中,用手握住试管观察,若导管口产生连续气泡,松开手有小段水柱回流,则装置A气密性良好,故答案为:连好装置,①处接长导管,将导管伸入盛有水的烧杯中,用手握住试管观察,若导管口产生连续气泡,松开手有小段水柱回流,则装置A气密性良好;
(2)乙二酸晶体熔点101.5℃,乙二酸晶体分解之前先熔化,试管口必须朝上,否则液体会聚集在试管口,因此A装置是正确的,故答案为:否;乙二酸晶体分解之前先熔化,试管口必须朝上,否则液体会聚集在试管口;
(3)乙二酸晶体加热分解生成CO2和CO装置A中的①导出气体,此实验验证是反应产物中含有CO2和CO(装置不能重复使用),应首先验证二氧化碳①→⑤→④,然后除去二氧化碳④→⑥→⑦,验证二氧化碳的方法是:把气体通入澄清的石灰水,澄清石灰水变浑浊,则含有二氧化碳;然后除去二氧化碳,二氧化碳与氢氧化钠反应除去,剩余为一氧化碳,验证一氧化碳存在⑦→②→③,一氧化碳与氧化铜反应生成二氧化碳,然后通入澄清石灰水,澄清石灰水变浑浊,则含有一氧化碳,故答案为:⑤④⑥⑦②③;
(4)一氧化碳有毒,一氧化碳具有可燃性,尾气处理的方法是点燃,2CO+O2![]() 2CO2,一氧化碳燃烧生成二氧化碳,所以在导管③后放置一个燃着的酒精灯(或用气囊收集),故答案为:缺少尾气处理装置,应在导管③后放置一个燃着的酒精灯(或用气囊收集);
2CO2,一氧化碳燃烧生成二氧化碳,所以在导管③后放置一个燃着的酒精灯(或用气囊收集),故答案为:缺少尾气处理装置,应在导管③后放置一个燃着的酒精灯(或用气囊收集);
(5)一氧化碳与氧化铜反应CuO+CO![]() Cu+CO2生成二氧化碳,B装置中黑色氧化铜变红,B中澄清石灰水变浑浊,则含CO,故答案为:B装置中黑色氧化铜变红,澄清石灰水变浑浊,则含CO;
Cu+CO2生成二氧化碳,B装置中黑色氧化铜变红,B中澄清石灰水变浑浊,则含CO,故答案为:B装置中黑色氧化铜变红,澄清石灰水变浑浊,则含CO;
(6)12.6克H2C2O42H2O的物质的量为n=![]() =
=![]() =0.1mol,乙二酸晶体加热分解H2C2O42H2O
=0.1mol,乙二酸晶体加热分解H2C2O42H2O![]() 3H2O+CO2↑+CO↑,则生成的一氧化碳、二氧化碳的物质的量分别为:0.1mol、0.1mol,反应产生的气体全部排出,并与吸收液充分反应,C装置中n(Ca(OH)2)=cV=0.05mol/L×0.1L=0.005mol,CO2+Ca(OH)2=CaCO3↓+H2O、CO2+H2O+CaCO3=Ca(HCO3)2,即2CO2+Ca(OH)2=Ca(HCO3)2,则吸收的二氧化碳为0.01mol,剩余二氧化碳的物质的量为:0.1mol-0.01mol=0.09mol,0.09mol二氧化碳全部进入D装置且被吸收,D中n(NaOH)=cv=1mol/L×0.1L=0.1mol,
3H2O+CO2↑+CO↑,则生成的一氧化碳、二氧化碳的物质的量分别为:0.1mol、0.1mol,反应产生的气体全部排出,并与吸收液充分反应,C装置中n(Ca(OH)2)=cV=0.05mol/L×0.1L=0.005mol,CO2+Ca(OH)2=CaCO3↓+H2O、CO2+H2O+CaCO3=Ca(HCO3)2,即2CO2+Ca(OH)2=Ca(HCO3)2,则吸收的二氧化碳为0.01mol,剩余二氧化碳的物质的量为:0.1mol-0.01mol=0.09mol,0.09mol二氧化碳全部进入D装置且被吸收,D中n(NaOH)=cv=1mol/L×0.1L=0.1mol,
CO2 + 2NaOH=Na2CO3+H2O CO2 + H2O+Na2CO3 =2NaHCO3
0.05mol 0.1mol 0.05mol 0.09mol-0.05mol 0.04mol 0.08mol
所以D中溶质及对应的物质的量是0.01molNa2CO3和0.08molNaHCO3,故答案为:0.01molNa2CO3和0.08molNaHCO3。

 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案【题目】某化学小组采用类似制乙酸乙酯的装置,用环己醇制备环己烯:
已知: 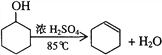
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | -103 | 83 | 难溶于水 |
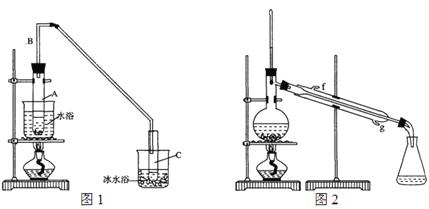
(1)制备粗品:采用如图1所示装置,用环己醇制备环己烯。
将12.5 mL环己醇加入试管A中,再加入1 mL浓硫酸,摇匀放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是_____________,导管B的作用是_______________。
②试管C置于冰水浴中的目的是________________________。
(2)制备精品:
①环己烯粗品中含有环己醇和少量有机酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在______层(填“上”或“下”),分液后用________洗涤(填字母)。
A. KMnO4溶液 B. 稀H2SO4 C. Na2CO3溶液
②再将环己烯按图2装置蒸馏,冷却水从____口(填字母)进入。蒸馏时加入生石灰,目的是______________________________________。
③收集产品时,控制的温度应在______左右,实验制得的环己烯精品质量低于理论产量,可能的原因是______(填字母)。
a. 蒸馏时从70℃开始收集产品
b. 环己醇实际用量多了
c. 制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是________(填字母)。
a. 用酸性高锰酸钾溶液
b. 用金属钠
c. 测定沸点