题目内容
【题目】根据问题填空:
(1)将煤转化为水煤气是通过化学方法将煤转化为洁净燃料的方法之一.已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为: C(s)+O2(g)=CO2(g)△H1=﹣393.5kJmol﹣1
H2(g)+ ![]() O2(g)=H2O(g)△H2=﹣242.0kJmol﹣1
O2(g)=H2O(g)△H2=﹣242.0kJmol﹣1
CO(g)+ ![]() O2(g)=CO2(g)△H3=﹣283.0kJmol﹣1
O2(g)=CO2(g)△H3=﹣283.0kJmol﹣1
根据以上数据,写出C(s)与水蒸气反应生成CO(g)和H2(g)的热化学方程式: .
(2)已知白磷和PCl3的分子结构如图所示,现提供以下化学键键能: P﹣P 198kJmol﹣1 , Cl﹣Cl 243kJmol﹣1 , P﹣Cl 331kJmol﹣1 .
则反应P4(白磷,s)+6Cl2(g)=4PCl3(s)的反应热△H= . 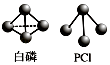
【答案】
(1)C(s)+H2O(g)=CO(g)+H2(g)△H=+131.5kJ?mol﹣1
(2)﹣1326kJ?mol﹣1
【解析】解:(1)①C(s)+O2(g)=CO2(g)△H1=﹣393.5kJmol﹣1
②H2(g)+ ![]() O2(g)=H2O(g)△H2=﹣242.0kJmol﹣1
O2(g)=H2O(g)△H2=﹣242.0kJmol﹣1
③CO(g)+ ![]() O2(g)=CO2(g)△H3=﹣283.0kJmol﹣1
O2(g)=CO2(g)△H3=﹣283.0kJmol﹣1
由盖斯定律可知,①﹣②﹣③得到C(s)+H2O(g)=CO(g)+H2(g),则△H=(﹣393.5kJmol﹣1)﹣(﹣242.0kJmol﹣1)﹣(﹣283.0kJmol﹣1)=+131.5 kJmol﹣1,
则热化学方程式为C(s)+H2O(g)=CO(g)+H2(g)△H=+131.5 kJmol﹣1,
所以答案是:C(s)+H2O(g)=CO(g)+H2(g)△H=+131.5 kJmol﹣1;(2)P4(白磷,s)+6Cl2(g)=4PCl3(s)的反应热△H=(198kJmol﹣1)×6+(243kJmol﹣1)×6﹣(331kJmol﹣1)×4×3=﹣1326 kJmol﹣1,
所以答案是:﹣1326 kJmol﹣1.

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案