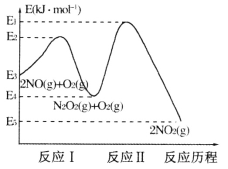
题目内容
【题目】铁和氧化铁的混合物共2mol,加盐酸后固体全部溶解,共收集到0.5molH2,且溶液中加入KSCN溶液不显红色,则原混合物中铁的物质的量为
A.0.5molB.1.5molC.0.75molD.1.25mol
【答案】D
【解析】
根据电子转移守恒,与H+ 反应生成H2 的铁的物质的量等于氢气的物质的量,即:n(Fe)=n(H2 )= 0.5mol,其余的铁则和Fe2 O3 以等物质的量溶于盐酸生成FeCl2,即Fe+ Fe2O3+6H+ =3Fe2+ +3H2 O,参加该反应的铁的物质的量为:n(Fe)=![]() (2mol-0.5mol)=0.75mol,故原混合物中共含铁:0.5mol +0.75mol=1.25mol;
(2mol-0.5mol)=0.75mol,故原混合物中共含铁:0.5mol +0.75mol=1.25mol;
答案选D。

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案
相关题目
【题目】利用某冶金行业产生的废渣(主要含![]() ,还有少量
,还有少量![]() 、
、![]() 等杂质)可以制备
等杂质)可以制备![]() ,生产流程如下:
,生产流程如下:
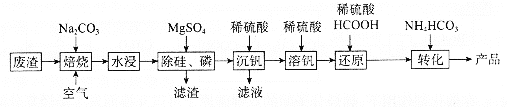
已知:![]() 微溶于水、溶于碱生成
微溶于水、溶于碱生成![]() (加热生成
(加热生成![]() ),具有强氧化性。向
),具有强氧化性。向![]() 溶液中加酸,不同
溶液中加酸,不同![]() 对应的主要存在形式如表:
对应的主要存在形式如表:
|
| 10.6~12 | 约8.4 | 3~8 | 约2 | <1 |
存在形式 |
|
|
|
|
|
|
回答下列问题:
(1)“焙烧”后V元素转化为![]() ,
,![]() 元素转化为________(写化学式)。
元素转化为________(写化学式)。
(2)欲除尽磷元素(即![]() ),最终溶液中
),最终溶液中![]() 的浓度至少为________
的浓度至少为________![]() (已知
(已知![]() )。
)。
(3)“沉钒”过程中,![]() 由8.5到5.0发生反应的离子方程式为________;最终需要控制
由8.5到5.0发生反应的离子方程式为________;最终需要控制![]() 约为________;“沉钒”最终得到的主要含钒物质是________(写化学式)。
约为________;“沉钒”最终得到的主要含钒物质是________(写化学式)。
(4)“还原”和“转化”过程中主要反应的离子方程式分为________、________。