题目内容
将3.9g Mg、Al合金溶于400mL一定物质的量浓度的HCl溶液中,恰好完全反应,再向反应后的溶液中加入等体积1mol/L的NaOH溶液时,生成沉淀的量最大(反应过程中溶液的体积变化忽略不计),求:
(1)生成沉淀的最大物质的量是多少?
(2)原HCl溶液的物质的量浓度?
(1)氢氧化钠的物质的量为:0.4L×1mol/L=0.4mol,令Mg、Al的物质的量分别为xmol、ymol,则:

解得:x=0.05,y=0.1,
故沉淀的最大物质的量为:0.05mol+0.1mol=0.15mol,
答:所得沉淀的最大物质的量为0.15mol;
(2)根据Cl原子守恒有n(HCl)=n(NaCl),故钠离子守恒有n(NaCl)=n(NaOH),故n(HCl)=n(NaOH),原盐酸与氢氧化钠溶液的体积相等,根据c=
 可知,二者浓度相等,故原盐酸溶液的浓度为1mol/L,
可知,二者浓度相等,故原盐酸溶液的浓度为1mol/L,答:原盐酸溶液的浓度为1mol/L.
分析:Mg、Al合金溶于HCl溶液中,恰好完全反应,反应后的溶液中溶质为MgCl2、AlCl3,再向反应后的溶液中加入NaOH溶液,生成沉淀的量最大,故镁离子、铝离子与氢氧根离子恰好反应生成Mg(OH)2、Al(OH)3,故所得的溶液中溶质为NaCl,
根据电荷守恒可知,Mg、Al合金提供的电子的物质的量等于氢氧根的物质的量,
(1)令Mg、Al的物质的量分别为xmol、ymol,根据二者质量之和与提供的电子的物质的量列方程计算x、y的值,进而计算Mg(OH)2、Al(OH)3的物质的量之和;
(2)根据Cl原子守恒有n(HCl)=n(NaCl),故钠离子守恒有n(NaCl)=n(NaOH),故n(HCl)=n(NaOH),原盐酸与氢氧化钠溶液的体积相等,根据c=
 可知,二者浓度相等.
可知,二者浓度相等.点评:考查混合物的有关计算、氧化还原反应的有关计算等,难度中等,清楚反应过程与判断计算提供的电子的物质的量等于氢氧根的物质的量是关键,

某研究性学习小组的同学探索工业含铝、铁、铜合金废料的再利用,甲同学设计的实验方案如下:
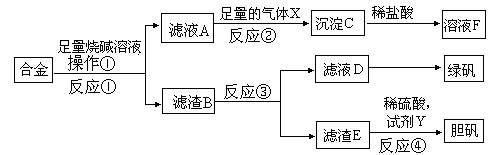
请回答:
(1)写出反应②的离子反应方程式__________________________________________。
(2)在滤渣E中加入稀硫酸和试剂Y制胆矾晶体是一种绿色化学工艺,试剂Y为无色液体,反应④的总化学方程式是_____________________________________。
(3)乙同学在甲同学方案的基础上提出用滤渣B来制备 FeCl3??6H2O晶体,是将所得氯化铁溶液用加热浓缩、降温结晶法制得FeCl3??6H2O晶体,而不用直接蒸发结晶的方法来制得晶体的理由是__________________
(4)丙同学设计如下方案测定甲同学所制得的绿矾晶体中结晶水含量,其方法过程如下
①称取mg己研细的新制得的绿矾晶体,称量的方法是___________
a.直接将晶体放置于天平托盘上所垫的纸片上称量
b.将晶体置于干燥的坩埚中,然后再按a中操作进行称量
c.将晶体置于己准确称量的干燥坩埚中,然后再按a中操作进行称量
②在氮气流环境中加热坩埚中晶体使其失去全部结晶水后再停止加热,并仍在氮气流环境下冷却。放在氮气流中加热与冷却的原因是____________________________
③将坩埚放在天平上进行称量,称得质量为n1g
④重复②、③的操作,称得的质量为n2g,表明不需要再加热再称量的依据是________
⑤下表数据来是该同学实验报告中的数据,试求出晶体中X=_______
| 实验编号 | 坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 |
| 1 | 11.2g | 25.1g | 19.2g |
| 2 | 11.2g | 25.1g | 18.8g |
| 3 | 11.2g | 25.1g | 18.9g |