题目内容
下列各溶液中,微粒的物质的量浓度关系正确的是( )
| A、10mL 0.5mol?L-1 CH3COONa溶液与6mL 1mol?L-1盐酸混合:c(Cl-)>c(Na+)>c(H+)>c(OH-) |
| B、0.1mol?L-1 pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-) |
| C、在NaHA溶液中一定有:c(Na+)+c(H+)═c(HA-)+c(OH-)+c(A2-) |
| D、0.1mol?L-1 CH3COONa溶液中:c(OH-)═c(CH3COOH)+c(H+) |
考点:离子浓度大小的比较,盐类水解的应用
专题:盐类的水解专题
分析:A.二者混合后溶液中的溶质为NaCl、CH3COOH、HCl,溶液呈酸性,结合物料守恒判断c(Cl-)、c(Na+)相对大小;
B.0.1mol?L-1 pH为4的NaHB溶液中HB-的电离程度大于水解程度;
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
D.任何溶液中都存在质子守恒,根据质子守恒判断.
B.0.1mol?L-1 pH为4的NaHB溶液中HB-的电离程度大于水解程度;
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
D.任何溶液中都存在质子守恒,根据质子守恒判断.
解答:
解:A.二者混合后溶液中的溶质为NaCl、CH3COOH、HCl,溶液呈酸性,结合物料守恒得c(Cl-)>c(Na+),溶液中NaCl、CH3COOH的物质的量相等,HCl的浓度为NaCl浓度的
,所以溶液中氢离子浓度小于钠离子浓度,则溶液中离子浓度大小顺序是c(Cl-)>c(Na+)>c(H+)>c(OH-),故A正确;
B.0.1mol?L-1的NaHB溶液呈酸性,说明HB-的电离程度大于水解程度,则c(H2B)<c(B2-),故B错误;
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)═c(HA-)+c(OH-)+2c(A2-),故C错误;
D.任何溶液中都存在质子守恒,根据质子守恒得c(OH-)═c(CH3COOH)+c(H+),故D正确;
故选AD.
| 1 |
| 5 |
B.0.1mol?L-1的NaHB溶液呈酸性,说明HB-的电离程度大于水解程度,则c(H2B)<c(B2-),故B错误;
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)═c(HA-)+c(OH-)+2c(A2-),故C错误;
D.任何溶液中都存在质子守恒,根据质子守恒得c(OH-)═c(CH3COOH)+c(H+),故D正确;
故选AD.
点评:本题考查了离子浓度大小比较,根据溶液中溶质及其性质再结合溶液酸碱性,利用守恒思想分析解答,题目难度中等.

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目
下列各溶液中能大量共存的离子组是( )
| A、使酚酞试液呈红色的溶液中:Mg2+、Cu2+、SO32-、K+ |
| B、使pH试纸呈红色的溶液中:Fe2+、I-、NO3-、Cl- |
| C、使石蕊试液呈蓝色的溶液中:Na+、NH4+、S2-、SO32- |
| D、在pH=1的无色溶液中:NH4+、Mg2+、SO42-、Cl- |
下列物质的性质比较中,错误的是( )
| A、酸性:HClO4<H2SO4<H3PO4 |
| B、原子半径:Si>C>N |
| C、氧化性:Na+<Mg2+<Al3+ |
| D、热稳定性:HF>HCl>HBr>HI |
下列说法中,错误的是( )
| A、将Fe(OH)3加入到滴有酚酞试液的蒸馏水中,酚酞试液变为红色 |
| B、使用石蕊试液或酚酞试液,都能将氯化钠溶液、氢氧化钠溶液、稀硫酸鉴别开 |
| C、酸式盐硫酸氢钠的溶液能使石蕊试液显红色 |
| D、某无色溶液中滴入AgNO3溶液而出现白色沉淀,原无色溶液中可能含有Cl- |
苯有多种同系物,其中一种结构简式为: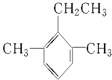 ,则它的名称为( )
,则它的名称为( )
 ,则它的名称为( )
,则它的名称为( )| A、2,4-二甲基-3-乙基苯 |
| B、1,3-二甲基-2-乙基苯 |
| C、1,5-二甲基-6-乙基苯 |
| D、2-乙基-1,3-二甲基苯 |
下列离子方程式书写正确的是( )
| A、金属钠和水的反应:Na+2H2O═H2↑+Na++OH- |
| B、Al(OH)3沉淀中滴加盐酸:Al(OH)3+3H+═Al3++3H2O |
| C、FeCl2溶液中通入Cl2:Fe2++Cl2═Fe3++2Cl- |
| D、醋酸溶液中滴加氢氧化钠:H++OH-═H2O |
氯气是一种重要的工业原料.工业上利用反应:3Cl2+8NH3═N2+6NH4Cl,检查氯气管道是否漏气.下列说法错误的是( )
| A、若管道漏气遇氨就会产生白烟 |
| B、该反应利用了氨气的还原性 |
| C、该反应属于复分解反应 |
| D、生成6mol NH4Cl有6mol电子转移 |
关于有机物的说法中不正确的是( )
| A、正丁烷和异丁烷的熔、沸点不相同 |
| B、乙烯、苯、乙酸分子中的所有原子都在同一平面上 |
| C、C4H9Br的同分异构体有3种 |
| D、乙烯和甲烷可用酸性高锰酸钾溶液鉴别 |
在2升的密闭容器中,发生以下反应:2A(g)+B(g)?2C(g)+D(g),若最初加入的A和B都是2mol,在前10秒钟A的平均反应速度为0.04mol/(L?s),则10秒钟时,容器中B的物质的量是( )
| A、0.8 mol |
| B、1.2 mol |
| C、1.6 mol |
| D、1.8 mol |