题目内容
下列物质的性质比较中,错误的是( )
| A、酸性:HClO4<H2SO4<H3PO4 |
| B、原子半径:Si>C>N |
| C、氧化性:Na+<Mg2+<Al3+ |
| D、热稳定性:HF>HCl>HBr>HI |
考点:非金属在元素周期表中的位置及其性质递变的规律,微粒半径大小的比较,氧化性、还原性强弱的比较
专题:元素周期律与元素周期表专题
分析:A.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
B.原子核外电子层数越多,半径越大,同周期元素从左到右原子半径逐渐减小;
C.元素的金属性越强,对应阳离子的氧化性越弱;
D.元素的非金属性越强,对应的氢化物越稳定.
B.原子核外电子层数越多,半径越大,同周期元素从左到右原子半径逐渐减小;
C.元素的金属性越强,对应阳离子的氧化性越弱;
D.元素的非金属性越强,对应的氢化物越稳定.
解答:
解;A.非金属性:Cl>S>Pi,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,则有:酸性:HClO4>H2SO4>H3PO4,故A错误;
B.Si、C位于相同主族,原子半径Si>C,C、N位置相同周期,原子半径C>N,故B正确;
C.金属性Na>Mg>Al,元素的金属性越强,对应阳离子的氧化性越弱,故C正确;
D.非金属性F>Cl>Br>I,元素的非金属性越强,对应的氢化物越稳定,故D正确.
故选A.
B.Si、C位于相同主族,原子半径Si>C,C、N位置相同周期,原子半径C>N,故B正确;
C.金属性Na>Mg>Al,元素的金属性越强,对应阳离子的氧化性越弱,故C正确;
D.非金属性F>Cl>Br>I,元素的非金属性越强,对应的氢化物越稳定,故D正确.
故选A.
点评:本题考查元素及其对应单质、化合物的性质的递变规律,题目难度不大,注意元素的金属性、非金属性与元素性质的递变规律.

练习册系列答案
 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案
相关题目
下列说法正确的是( )
| A、油脂发生皂化反应能生成高级脂肪酸 |
| B、氨基酸、二肽和蛋白质均既能跟强酸反应,又能和强碱反应 |
| C、蔗糖、麦芽糖、硬脂酸甘油酯酸性水解都能得到2种物质 |
| D、天然油脂是高分子化合物 |
下列物质既能使溴水褪色,又能使酸性高锰酸钾溶液褪色的是( )
| A、CH4 |
| B、C2H4 |
| C、C6H6 |
| D、C3H8 |
按图装置进行实验,下列描述正确的是(N装置中两个电极均为石墨棒)( )
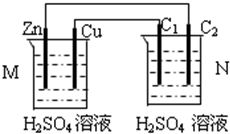

| A、C1上发生还原反应 |
| B、M装置中SO42-移向Cu电极 |
| C、工作一段时间后装置M、N中溶液PH均变大 |
| D、Cu电极与C2电极上的电极反应相同 |
下列说法正确的是( )
| A、单质分子中不存在化学键,化合物的分子才存在化学键 |
| B、共价化合物中一定没有非极性键 |
| C、离子化合物中一定含有离子键 |
| D、氢键是一种特殊的化学键 |
下列各组物质变化时,所克服的微粒间的相互作用或作用力属同种类型的是( )
| A、碘的升华和NH4Cl的“升华” |
| B、冰的融化和石英的熔化 |
| C、NaCl熔化和NaOH溶于水 |
| D、溴的挥发和NH4HCO3的分解 |
能正确表示下列反应的离子方程式是( )
| A、醋酸与水垢的反应:CO32-+2H+═CO2+H2O |
| B、苯酚钠溶于碳酸溶液:2C6H5O-+CO2+H2O→2C6H5OH+CO32- |
| C、硫酸铜溶液与硫化氢的反应:Cu2++H2S═CuS↓+2H+ |
| D、氢氧化钙溶液和碳酸镁的反应:Ca2++CO32-═CaCO3↓ |
下列各溶液中,微粒的物质的量浓度关系正确的是( )
| A、10mL 0.5mol?L-1 CH3COONa溶液与6mL 1mol?L-1盐酸混合:c(Cl-)>c(Na+)>c(H+)>c(OH-) |
| B、0.1mol?L-1 pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-) |
| C、在NaHA溶液中一定有:c(Na+)+c(H+)═c(HA-)+c(OH-)+c(A2-) |
| D、0.1mol?L-1 CH3COONa溶液中:c(OH-)═c(CH3COOH)+c(H+) |
CH3CH2OH分别跟H18OOCC2H5和H16OOCC2H5酯化反应后,两者生成水的摩尔质量( )
| A、前者大 | B、前者小 |
| C、相等 | D、不能确定 |