题目内容
【题目】氢气因热值高、来源广、产物无污染,常被人们看做一种理想的“绿色能源”,氢气的制取是氢能源利用领域的研究热点。
(1)H2O的热分解可得到H2,高温下水分解体系中主要气体的体积分数与温度的关系如图1所示。图1中曲线A对应的物质是______________。
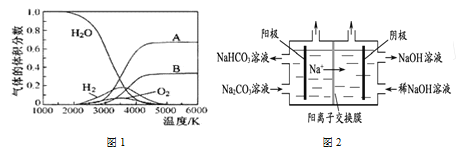
(2)图2为用电解法制备H2,写出阳极的电极反应式:________________。
(3)从可持续发展考虑,太阳能光解水制氢是获取H2的最好途径,但迄今仍然存在诸多问题,如光催化剂大多仅在紫外光区稳定有效,能够在可见光区使用的光催化剂不但催化活性低,而且几乎都存在光腐蚀现象,需使用牺牲剂进行抑制,能量转化效率低等,这些都阻碍了光解水的实际应用,需设计课题进一步研究解决。下列设想符合研究方向的是_________
A 将研究方向专注于紫外光区,无需考虑可见光区
B 研究光腐蚀机理,寻找高稳定性,不产生光腐蚀的制氢材料
C 研制具有特殊结构的新型光催化剂,开发低成本、高性能光催化材料
D 研究新的光解水的催化机制,使利用红外光进行光解水制氢成为可能
(4)以甲烷为原料制取氢气是工业上常用的制氢方法。
已知:CH4(g) + H2O(g) = CO(g)+ 3H2 (g) ΔH= -206.2 kJmol-1
CH4(g) + CO2 (g) = 2CO(g)+ 2H2 (g) ΔH= -247.4 kJmol-1
则CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为:_________
(5)利用废弃的H2S的热分解可生产H2:2H2S(g) ![]() 2H2(g)+S2(g)。现将0.30 mol H2S(g)通入到压强为p的恒压密闭容器中,在不同温度下测得H2S的平衡转化率如图3所示:
2H2(g)+S2(g)。现将0.30 mol H2S(g)通入到压强为p的恒压密闭容器中,在不同温度下测得H2S的平衡转化率如图3所示:
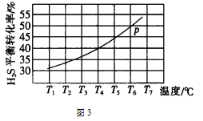
①温度为T4℃时,初始体积为1L,t分钟后,反应达到平衡,该温度下的平衡常数K=________。
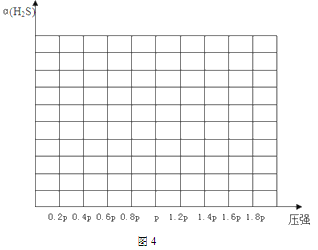
②若保持恒温T℃,将一定量的 H2S(g)通入到恒压密闭容器中,反应一段时间后,压强为p的体系恰好达到平衡,试在图4上画出不同起始压强下H2S转化率的趋势图________。
【答案】H(或氢)原子 4CO32- + 2H2O -4e- = O2 + 4HCO3- BCD CH4(g) + 2H2O(g) = CO2(g) + 4H2(g) △H= - 165.0kJ . mol-1 1/45或2.2 ×10-2 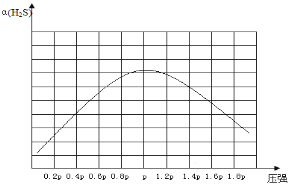
【解析】
(1)由图可知,水的分解化学键断裂先生成H原子与O原子,氢原子结合生成氢气,氧原子结合生成氧气,由水的分子式可知氢原子物质的量是氧原子2倍,故A为氢原子、B为氧原子;故答案为H(或氢)原子;
(2)图2为用电解法制备H2,根据图中信息可知,阳极上碳酸根离子转化为碳酸氢根离子,碳的化合价不变,则应由水电离产生的氢氧根离子失电子产生氧气,结合电子得失知,阳极的电极反应式为:4CO32- + 2H2O -4e-=O2 + 4HCO3-;
(3)A、光催化剂大多仅在紫外光区稳定有效,能够在可见光区使用的光催化剂不但催化活性低,但催化剂有选择性,不同催化剂的效果不同,而且几乎都存在光腐蚀现象,需使用牺牲剂进行抑制,将研究方向专注于紫外光区,同时也要考虑可见光区,选项A错误;
B、光催化剂能够在可见光区使用的光催化剂不但催化活性低,而且几乎都存在光腐蚀现象,需使用牺牲剂进行抑制,必须研究光腐蚀机理,寻找高稳定性,不产生光腐蚀的制氢材料,选项B正确;
C、研制具有特殊结构的新型光催化剂,开发低成本、高性能光催化材料,提高能量转化效率,选项C正确;
D、光催化剂能够在可见光区使用的光催化剂不但催化活性低,需使用牺牲剂进行抑制,故需研究新的光解水的催化机制,使利用红外光进行光解水制氢,选项D正确;
答案选BCD;
(4)已知:①CH4(g) + H2O(g)=CO(g)+ 3H2 (g) ΔH1= -206.2 kJmol-1
②CH4(g) + CO2 (g)=2CO(g)+ 2H2 (g) ΔH2= -247.4 kJmol-1
根据盖斯定律,由①![]() 2-②得反应CH4(g) + 2H2O(g)=CO2(g) + 4H2(g) ΔH= ΔH1
2-②得反应CH4(g) + 2H2O(g)=CO2(g) + 4H2(g) ΔH= ΔH1![]() 2-ΔH2= - 165.0kJ . mol-1;
2-ΔH2= - 165.0kJ . mol-1;
(5)①温度为T4℃时,初始体积为1L,t分钟后,反应达到平衡,0.30 mol H2S(g),H2S的转化率为40%,根据反应2H2S(g)![]() 2H2(g)+S2(g)可知,平衡时各物质的量浓度分别为0.18mol/L、0.12mol/L、0.06mol/L,该温度下的平衡常数K=
2H2(g)+S2(g)可知,平衡时各物质的量浓度分别为0.18mol/L、0.12mol/L、0.06mol/L,该温度下的平衡常数K=![]() =1/45=2.2 ×10-2;
=1/45=2.2 ×10-2;
②若保持恒温T℃,将一定量的H2S(g)通入到恒压密闭容器中,反应一段时间后,压强为p的体系恰好达到平衡,反应为气体体积增大的反应,随着反应的进行,H2S的转化率增大,当达平衡后,增大压强,平衡逆向移动,H2S转化率减小,故不同起始压强下H2S转化率的趋势图为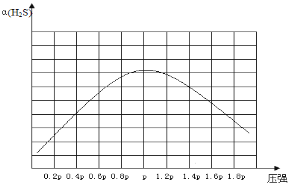 。
。

【题目】七水硫酸镁(MgSO4·7H2O)在印染、造纸和医药等工业上有重要的用途。硼镁泥是硼镁矿生产硼砂的废渣,其主要成分是MgCO3,还含有MgO、CaO、Fe2O3、FeO、MnO2、Al2O3、SiO2等杂质,工业上用硼镁泥制取七水硫酸镁的工艺流程如图:
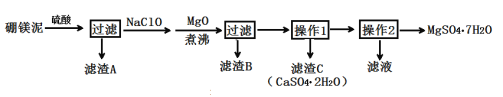
已知:①MnO2不溶于稀硫酸。
②CaSO4和MgSO4·7H2O在不同温度下的溶解度(g)数据如下表所示:
温度/℃ 物质 | 10 | 30 | 40 | 50 | 60 |
CaSO4 | 0.19 | 0.21 | 0.21 | 0.21 | 0.19 |
MgSO4·7H2O | 30.9 | 35.5 | 40.8 | 45.6 | —— |
(1)开始用到硫酸的质量分数为70%,密度为1.61g/cm3,则该硫酸溶液的物质的量浓度为___。
(2)滤渣A中除含少量CaSO4·2H2O外,还有___。
(3)加入MgO后,加热煮沸的目的是___。
(4)若滤渣B的主要成分为Al(OH)3和Fe(OH)3。则加入NaClO发生氧化还原反应的离子方程式为___。
(5)流程中操作1为蒸发浓缩、趁热过滤,这样即可得到CaSO4·2H2O,又防止___。
(6)获取MgSO4·7H2O的操作2为:___、___、过滤洗涤。
(7)已知开始硼镁泥样品的质量为ag,制取七水硫酸镁的质量为bg,据此能计算出硼镁泥中镁元素的含量吗?若能,请写出表达式;若不能,请说明理由。___(能或不能),表达式(或理由)为___。