题目内容
2 g Cu2S和CuS的混合物在酸性溶液中用400 mL 0.075 mol·L-1 KMnO4溶液处理,发生反应如下:
8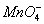 +5Cu2S+44H+====12Cu2++5SO2+8Mn2++22H2O
+5Cu2S+44H+====12Cu2++5SO2+8Mn2++22H2O
6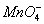 +5CuS+28H+====5Cu2++5SO2+6Mn2++14H2O
+5CuS+28H+====5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350 mL 0.1 mol·L-1(NH4)2Fe(SO4)2溶液完全反应。
(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:

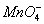 +
+ Fe2++
Fe2++ H+
H+ Mn2++
Mn2++ Fe3++
Fe3++ H2O
H2O
(2)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为_________mol。
(3)欲配制500 mL 0.1 mol·L-1 Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=392 g·mol-1)的质量为_________ g。
(4)混合物中Cu2S的质量分数为_________。
【答案】(1)1 5 8 1 5 4 (2)0.007 (3)19.6 (4)40%
【解析】根据配平后的离子方程式,KMnO4—5(NH4)2Fe(SO4)2,则剩余KMnO4的物质的量为: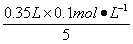 =0.07 mol。
=0.07 mol。
需称量固体的质量为:0.5 L×0.1 mol·L-1×392 g·mol-1=19.6 g
假设混合物中Cu2S的物质的量为x,CuS的物质的量为y,结合以上数据列出方程组:
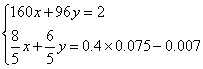 ,解得结果
,解得结果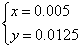 ,则混合物中Cu2S的质量分数为:
,则混合物中Cu2S的质量分数为: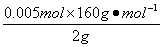 ×120%=40%。
×120%=40%。
【考点分析】氧化还原反应的配平及综合计算

练习册系列答案
相关题目
 Al2O3+N2+3C 2 AlN+3CO合成,下列叙述正确的是 ( )
Al2O3+N2+3C 2 AlN+3CO合成,下列叙述正确的是 ( )