题目内容
【题目】在一定条件下,CO和CH4燃烧的热化学方程式分别为 2CO(g)+O2(g)═2CO2(g)△H=﹣566kJmol﹣1
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣890kJmol﹣1
由1mol CO(g)和3mol CH4(g)组成的混合气体在上述条件下充分燃烧,恢复至室温释放的热量为( )
A.2912kJ
B.2953kJ
C.3236kJ
D.3867kJ
【答案】B
【解析】解:由2CO(g)+O2(g)═2CO2(g)△H=﹣566kJmol﹣1可知,1molCO燃烧放出的热量为 ![]() kJ=283kJ; 由CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣890kJmol﹣1可知,
kJ=283kJ; 由CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣890kJmol﹣1可知,
3molCH4(g)充分燃烧放出的热量为3×890kJ=2670kJ;
所以由1mol CO(g)和3mol CH4(g)组成的混合气体在上述条件下充分燃烧,
放出的热量为2670kJ+283kJ=2953kJ,
故选B.
根据热化学反应方程式中物质的量与反应放出的热量成正比来解答.

【题目】乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见下表:
物质 | 乙醛 | 乙酸 | 甘油 | 乙醇 | 水 |
沸点 | 20.8℃ | 117.9℃ | 290℃ | 78.5℃ | 100℃ |
请回答下列问题:
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件);
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在试管A 的反应液中,目的是;当试管A内的主要反应完成后温度计水银球的位置应在略低于试管A 的支管口处,目的是 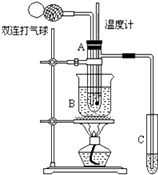
(3)烧杯B的作用是使试管A内的反应液均匀受热发生反应,烧杯B内盛装的液体可以是(在题给物质中找);
(4)若想检验试管C中是否含有产物乙酸,请你在所提供的药品中进行选择,设计一个简便的实验方案.所提供的药品有:pH试纸、红色的石蕊试纸、白色的醋酸铅试纸、碳酸氢钠粉末.实验仪器任选.该方案为 .