题目内容
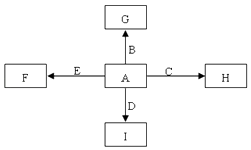
【题目】图中,A,B,C,D,E是单质,G,H,I,F是B,C,D,E分别和A形成的二元化合物.已知:①反应C+G ![]() B+H能放出大量的热,该反应曾应用于铁轨的焊接;
B+H能放出大量的热,该反应曾应用于铁轨的焊接;
②I是一种常见的温室气体,它和E可以发生反应:2E+ ![]() 2F+D,F中的E元素的质量分数为60%.回答问题:
2F+D,F中的E元素的质量分数为60%.回答问题:
(1)①中反应的化学方程式为
(2)化合物Ⅰ的电子式为 ,它的空间构型是 ;
(3)1.6g G 溶于盐酸,得到的溶液与铜粉完全反应,至少所需铜粉的质量为 g.
(4)C与过量NaOH溶液反应的离子方程式为 ,反应后溶液与过量化合物Ⅰ反应的离子方程式: ;
(5)实验室中一般检验I存在的试剂和方法是: .
【答案】
(1)2Al+Fe2O3 ![]() Al2O3+2Fe
Al2O3+2Fe
(2)![]() ;直线型
;直线型
(3)0.64
(4)2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑;AlO2﹣+CO2+2H2O=HCO3﹣+Al(OH)3↓
(5)试剂:澄清石灰水,方法:把CO2通入澄清石灰水中,若溶液出现浑浊说明有CO2存在
【解析】解:A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,
①反应C+G ![]() B+H能放出大量的热,该反应曾应用于铁轨的焊接,该反应为铝热反应,则C为Al,B为Fe,G为Fe2O3 , H为Al2O3 ,
B+H能放出大量的热,该反应曾应用于铁轨的焊接,该反应为铝热反应,则C为Al,B为Fe,G为Fe2O3 , H为Al2O3 ,
②I是一种常见的温室气体,则I为CO2 , 它和E可以发生反应:2E+I ![]() 2F+D,F中的E元素的质量分数为60%,则E为Mg,D为C,F为MgO,由图中转化可知,A为O2 . (1)①中反应的化学方程式为2Al+Fe2O3
2F+D,F中的E元素的质量分数为60%,则E为Mg,D为C,F为MgO,由图中转化可知,A为O2 . (1)①中反应的化学方程式为2Al+Fe2O3 ![]() Al2O3+2Fe,所以答案是:2Al+Fe2O3
Al2O3+2Fe,所以答案是:2Al+Fe2O3 ![]() Al2O3+2Fe;(2)I为二氧化碳,其电子式为
Al2O3+2Fe;(2)I为二氧化碳,其电子式为 ![]() ,为直线型分子,所以答案是:
,为直线型分子,所以答案是: ![]() ;直线型;(3)1.6g G其物质的量为
;直线型;(3)1.6g G其物质的量为 ![]() =0.01mol,由Fe2O3~2Fe3+~Cu可知,需要Cu的质量为0.01mol×64g/mol=0.64g,所以答案是:0.64;(4)C与过量NaOH溶液反应的化学方程式为2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑,反应后溶液与过量化合物Ⅰ反应的化学方程式为AlO2﹣+CO2+2H2O=HCO3﹣+Al(OH)3↓,
=0.01mol,由Fe2O3~2Fe3+~Cu可知,需要Cu的质量为0.01mol×64g/mol=0.64g,所以答案是:0.64;(4)C与过量NaOH溶液反应的化学方程式为2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑,反应后溶液与过量化合物Ⅰ反应的化学方程式为AlO2﹣+CO2+2H2O=HCO3﹣+Al(OH)3↓,
所以答案是:2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑;AlO2﹣+CO2+2H2O=HCO3﹣+Al(OH)3↓;(5)I为CO2 , 实验室中一般检验I存在的试剂是,方法是澄清石灰水:把CO2通入澄清石灰水中,若溶液出现浑浊说明有CO2存在,所以答案是:试剂:澄清石灰水,方法:把CO2通入澄清石灰水中,若溶液出现浑浊说明有CO2存在.

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案【题目】下图表示细胞内某些有机物的元素组成和功能关系,其中a、b代表元素,Ⅰ、Ⅱ、Ⅲ、Ⅳ是生物大分子,X、Y、Z、P分别为构成生物大分子的基本单位,请回答下列问题:

(1)图中A是__________________________。
(2)图中X是_____________________,Ⅰ在小麦种子中主要是指______________________。
(3)图中Z是____________,使用甲基绿、派洛宁混合染色剂染色,可使Ⅲ呈现__________色。
(4)图中P的结构通式为__________________,其形成Ⅳ的方式是_________;Ⅳ在结构上具有多样性,具体表现在______________________。
(5)用碘液、苏丹Ⅲ染液和双缩脲试剂测得甲、乙、丙三种植物的干种子中三大类有机物颜色反应如下表,其中“+”的数量代表颜色反应深浅程度,下列有关说法不正确的是 (____)
试剂种类 | 碘液 | 苏丹Ⅲ染液 | 双缩脲试剂 |
甲 | + + + + | + + | + |
乙 | + + | + + + + | + + |
丙 | + | + + | + + + + |
A.乙种子中主要含蛋白质
B.碘液、苏丹Ⅲ染液和双缩脲试剂与相应的物质发生的颜色反应分别是蓝色、橘黄色和紫色
C.在观察颜色时有可能用到光学显微镜
D.这三种试剂使用均不需要水浴加热
【题目】下列各组物质之间通过一步就能实现如图所示转化的是( )
物质编号 | 物质转化关系 | a | b | c | d |
1 |
| Na2O | Na2O2 | Na | NaOH |
② | Al2O3 | Na[Al(OH)4] | Al | Al(OH)3 | |
③ | FeCl2 | FeCl3 | Fe | CuCl2 | |
④ | NO | NO2 | N2 | HNO3 |
A.①②
B.②③
C.②④
D.①③