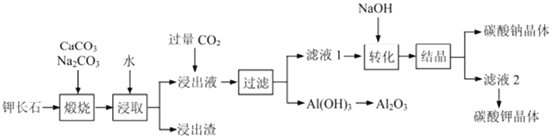
题目内容
【题目】常温下,用pH=m的盐酸滴定20mLpH=n的MOH溶液,且m+n=14,混合溶液的pH与盐酸体积(V)的关系如图所示。下列说法正确的是
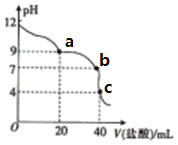
A. Kb(MOH)的数量级为10-11
B. 由c点可算得m=14/3
C. b点溶液呈中性,此时c(Cl-)=c(M+)
D. a点:c(Cl-)>c(M+)>c(OH-)>c(H+)
【答案】C
【解析】常温下,用pH=m的盐酸滴定20mLpH=n的MOH溶液,且m+n=14,则盐酸中氢离子浓度与MOH中氢氧根离子浓度相等,由于盐酸为强酸,且加入20mL盐酸时溶液呈碱性,说明MOH为弱碱,则MOH的浓度大于盐酸。A. 根据图像,c点盐酸与MOH恰好完全反应,因此的浓度为盐酸浓度的2倍,即c(MOH)=2c(HCl)=2×10-m mol/L,由于m+n=14, n-14 =-m,所以当MOH达到电离平衡时,c(MOH)= 2×10-m mol/L-10-m mol/L=10-m mol/L,Kb(MOH)=![]() =
=![]() = 10-m,由于pH=m是盐酸溶液,所以m<7,即Kb(MOH)大于10-7,故A错误;B. 根据图像,c点盐酸与MOH恰好完全反应,溶液总体积为60mL,pH=4,溶液中只含有MCl,浓度为
= 10-m,由于pH=m是盐酸溶液,所以m<7,即Kb(MOH)大于10-7,故A错误;B. 根据图像,c点盐酸与MOH恰好完全反应,溶液总体积为60mL,pH=4,溶液中只含有MCl,浓度为![]() =
=![]() ×10-m mol/L,c(H+)=10-4 mol/L,由于水解过程微弱,所以10-m >10-4,即m<4,因此m不可能等于14/3,故B错误;C.根据图像, b点溶液呈中性,c(H+)=c(OH-),根据电荷守恒,此时c(Cl-)=c(M+),故C正确;D.a点溶液为碱性,则c(OH-)>c(H+),根据电荷守恒可知c(M+)>c(Cl-),溶液中的离子浓度大小为:c(M+)>c(Cl-)>c(OH-)>c(H+),故D错误;故选C。
×10-m mol/L,c(H+)=10-4 mol/L,由于水解过程微弱,所以10-m >10-4,即m<4,因此m不可能等于14/3,故B错误;C.根据图像, b点溶液呈中性,c(H+)=c(OH-),根据电荷守恒,此时c(Cl-)=c(M+),故C正确;D.a点溶液为碱性,则c(OH-)>c(H+),根据电荷守恒可知c(M+)>c(Cl-),溶液中的离子浓度大小为:c(M+)>c(Cl-)>c(OH-)>c(H+),故D错误;故选C。