题目内容
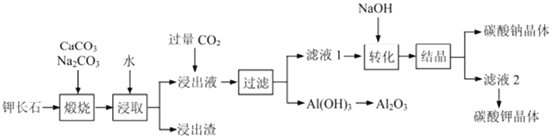
【题目】钾长石(K2Al2Si6O16)通常也称正长石,主要用于生产玻璃、陶瓷制品,还可用于制取钾肥。某学习小组以钾长石为主要原料,从中提取氧化铝、碳酸钾等物质,工艺流程如下:
回答以下问题:
(1) 请以氧化物组成的形式表示钾长石的化学式为_____________
(2) 钾长石中的钾元素和铝元素在Na2CO3作用下转化为可溶性的KAlO2 和NaAlO2,写出Al2O3 转化为NaAlO2 的化学方程式_____________________。
(3) 已知“浸取”时应保持溶液呈碱性,分析其原因为____________(用离子方程式解释),若要提高浸取的速率,可采取的措施有_______________(回答一条)。
(4) 滤液1的主要成分是_________(填写化学式)
(5) 此工艺中可以循环利用的主要物质是________、___________和水。
(6) 以石墨为电极,通过电解Al2O3 可制得金属铝。电解池中接电源负极的一极的电极反应式是_______。长时间电解后,需要更换新的石墨电极的是___极(填“阴”或“阳”)。
【答案】 K2O·Al2O3·6SiO2 Na2CO3+Al2O3![]() 2NaAlO2+CO2↑ AlO2-+2H2O
2NaAlO2+CO2↑ AlO2-+2H2O![]() Al(OH)3+OH- 不断搅拌(或适当加热、将固体粉粹成更小的颗粒) NaHCO3;KHCO3 Na2CO3 CO2 Al3++3e-=Al 阳
Al(OH)3+OH- 不断搅拌(或适当加热、将固体粉粹成更小的颗粒) NaHCO3;KHCO3 Na2CO3 CO2 Al3++3e-=Al 阳
【解析】试题分析:本题以钾长石为原料提取Al2O3、K2CO3的流程为载体,考查流程的分析、硅酸盐的表示、化学方程式的书写、盐类的水解、反应条件的控制、铝的冶炼。
(1)钾长石的化学式为K2Al2Si6O16,根据原子守恒,以氧化物组成的形式表示钾长石的化学式为K2O·Al2O3·6SiO2。
(2)Al2O3与Na2CO3在高温下反应生成NaAlO2和CO2,反应的化学方程式为Al2O3+Na2CO3![]() 2NaAlO2+CO2↑。
2NaAlO2+CO2↑。
(3)根据流程,浸出液中含KAlO2、NaAlO2,KAlO2、NaAlO2都属于强碱弱酸盐,溶液中存在水解平衡:AlO2-+2H2O![]() Al(OH)3+OH-;“浸取”时保持溶液呈碱性,可抑制AlO2-的水解。若用提高浸取的速率,可采取的措施有:不断搅拌、适当加热、将固体粉碎成更小的颗粒。
Al(OH)3+OH-;“浸取”时保持溶液呈碱性,可抑制AlO2-的水解。若用提高浸取的速率,可采取的措施有:不断搅拌、适当加热、将固体粉碎成更小的颗粒。
(4)向浸出液中通入过量CO2,发生的反应有:CO2+KAlO2+2H2O=Al(OH)3↓+KHCO3、CO2+NaAlO2+2H2O=Al(OH)3↓+NaHCO3,过滤滤出Al(OH)3,滤液1的主要成分为KHCO3、NaHCO3。
(5)根据流程,煅烧时产生CO2,浸出液中需要通入CO2;结晶后得到碳酸钠晶体,煅烧中需要Na2CO3;此工艺中可以循环利用的主要物质是Na2CO3、CO2和水。
(6)电解池中接电源负极的一极为阴极,阴极电极反应式为Al3++3e-=Al。以石墨为电极,电解熔融的Al2O3,阳极的电极反应式为2O2--4e-=O2↑,阳极生成的O2与石墨反应消耗石墨,长时间电解后,需要更换新的石墨电极的是阳极。

 阅读快车系列答案
阅读快车系列答案