题目内容
X、Y、Z和W代表原子序数依次增大的四种短周期元素,它们满足以下条件:
①元素周期表中,Z与Y相邻,Z与W相邻;
②X分别与Y、Z、W可组成化学式为YX3,X2Z和X2W三种共价化合物
请填空:
(1)X、Y、Z原子最外层电子数之和是________
(2)X2W的结构式是________
(3)X、Y和Z组成的一种化合物是强酸.写出该酸的稀溶液与铜反应的离子方程式:
________________________________________________________________________
含Y、Z的气体和一种只含X、Z的液体(在常温、常压下)反应可以生成一种离子化合物其化学式为________
(4)X、Y、Z和W组成一种化合物,其原子个数之比为5∶1∶3∶1;该化合物具有
还原性。
① 写出该化合物与过量稀NaOH溶液反应的离子方程式:
________________________________________________________________________.
② 请设计实验证明该化合物具有还原性:
________________________________________________________________________。
(9分) (1)12(1分)(2)H—??—H(1分)
(3)3Cu+ 8H++2NO=3Cu2++2NO↑+4H2O(2分) NH4NO3或NH4NO2(1分)
(4) ①NH+HSO+2OH-=NH3·H2O+H2O+SO(2分)
②取少许氯水,滴加该溶液,氯水褪色则说明该化合物具有还原性(KMnO4、溴水、
Fe3+等均可) (2分)
解析试题分析:X、Y、Z和W代表原子序数依次增大的四种短周期元素,它们满足以下条件:
①元素周期表中,Z与Y相邻,Z与W相邻;②X分别与Y、Z、W可组成化学式为YX3,X2Z和X2W三种共价化合物。这说明Y、Z是第二周期元素,W是第三周期元素。因此X是H,则Y是N,Z是O、W是S。
(1)X、Y、Z原子最外层电子数之和是1+5+6=12。
(2)H2S的结构和水的结构相似,则H2S的结构式是H—??—H。
(3)X、Y和Z组成的一种化合物是强酸,则该强酸是硝酸。硝酸具有强氧化性,能和铜发生氧化还原反应,则硝酸的稀溶液与铜反应的离子方程式3Cu+ 8H++2NO=3Cu2++2NO↑+4H2O。含H、N、O三种元素的一种离子化合物的化学式为NH4NO3或NH4NO2。
(4)①X、Y、Z和W组成一种化合物,其原子个数之比为5∶1∶3∶1,则该化合物是NH4HSO3,与过量稀NaOH溶液反应的离子方程式是NH+HSO+2OH-=NH3·H2O+H2O+SO。
②+4价的S元素具有还原性,所以验证其还原性的实验方法是取少许氯水,滴加该溶液,氯水褪色则说明该化合物具有还原性。
考点:考查元素的推断、结构式、方程式以及氧化性和还原性的检验等
点评:该题是中等难度的试题,试题贴近高考,基础性强,在注重对学生基础知识检验和训练的同时,侧重对学生能力的培养,有利于培养学生的逻辑推理能力和发散思维能力。准确判断出元素是答题的关键。

有X、Y、Z、W四种含14个电子的粒子,其结构特点如下:
| 粒子代码 | X | Y | Z | W |
| 原子核数 | 单核 | 不同元素构成的两核 | 同元素构成的两核 | 同元素构成的两核 |
| 粒子的电荷数 | 0 | 0 | 两个负电荷 | 0 |
(1)A原子核外比X原子多3个电子,A的原子结构示意图是 。含lmolX的氧化物晶体中含有共价键数目为 。
(2)Z与钙离子组成的化合物的电子式为 。
(3)14gY完全燃烧放出的热量是141.5kJ,写出Y燃烧的热化学方程式 。
(4)组成W的元素最高价氧化物对应的水化物甲有下图所示转化关系(丁为金属单质,反应条件和其他物质已略)

①写出丁元素在周期表中的位置 。
②写出丁在高温下与水反应的化学方程式 。
③组成W的元素的简单氢化物极易溶于水的主要原因是 ,该氢化物与空气可以构成一种燃料电池,电解质溶液是KOH,其负极的电极反应式为 。
不同元素的原子在分子内吸引电子的能力大小可用一定数值x来表示, x越大,其原子吸引电子的能力越强。 下面是某些短周期元素的x值:
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| x值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
(1)通过分析x值变化规律,确定Mg的x值范围:_______ < x(Mg) <_________。
(2)推测x值与原子半径的关系是________________________________;根据短周期元素的x值变化特点,体现了元素性质的_________________变化规律。
(3)分别指出下列两种化合物中氧元素的化合价:HClO_________,HFO________。
(4)经验规律告诉我们:当成键的两原子相应元素x数值的差值(Δx),当Δx>1.7时,一般为离子键,当Δx<1.7时,一般为共价键,试推断AlBr3中化学键类型是________________。
(5)预测元素周期表中,x值最小的元素位于______周期________族(放射性元素除外)。
(12分)下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
| 族 周期 | IA | | 0 | |||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | | | | ② | ③ | ④ | | |
| 3 | ⑤ | | ⑥ | | | ⑦ | ⑧ | ⑨ |
元素是 。(均填元素符号)
(2)元素⑦与元素⑧相比,⑧的非金属性较强,下列表述中能证明这一事实的是
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
d.⑦的氧化物的水化物比⑧的氧化物的水化物酸性弱
设计一个简单实验,证明元素⑦与元素⑧的非金属性强弱,只写出反应的化学方程式(不写实验步骤)______________________________________
(3)⑤与⑥两元素最高价氧化物的水化物相互反应的离子方程式为 _____________________________________________________
(4)③的氢化物的电子式为__________________
(5)①④⑤三种元素形成的最简单一种化合物含有的化学键类型有

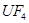 +
+ 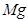 ——
——  +
+ 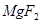
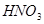 ——
—— 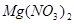 +
+ 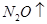 +
+ 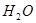
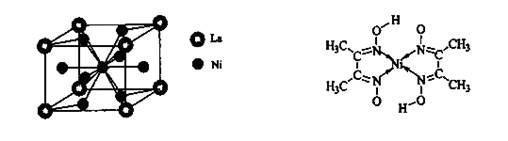
 键,碳氮之间的共价键类型是______________,氮镍之间形成的化学键是_______________;
键,碳氮之间的共价键类型是______________,氮镍之间形成的化学键是_______________; X,其氯化物XCl2 1.11 g配成溶液后,需用20 mL 1 mol·L-1的AgNO3溶液才能把氯离子完全沉淀下来。已知X核素中有20个中子。
X,其氯化物XCl2 1.11 g配成溶液后,需用20 mL 1 mol·L-1的AgNO3溶液才能把氯离子完全沉淀下来。已知X核素中有20个中子。