题目内容
6.下列各种情况下,溶液中可能大量存在的离子组是( )| A. | 无色溶液中:Cl-,Na+,Fe3+,SO42- | |
| B. | 水电离的H+浓度c(H+)=10-12mol/L的溶液中:Cl-,CO32-,NH4+,S2O32- | |
| C. | 使pH=1溶液中:K+、Fe2+、NO3-、Cl- | |
| D. | 含有HCO3-的溶液中:NH4+、K+、Na+、SO32-、SO42- |
分析 A.Fe3+为黄色;
B.水电离的H+浓度c(H+)=10-12mol/L的溶液,为酸或碱溶液;
C.pH=1溶液,显酸性,离子之间发生氧化还原反应;
D.该组离子之间不反应.
解答 解:A.Fe3+为黄色,与无色不符,故A错误;
B.水电离的H+浓度c(H+)=10-12mol/L的溶液,为酸或碱溶液,酸溶液中不能大量存在CO32-、S2O32-,碱溶液中不能大量存在NH4+,故B错误;
C.pH=1溶液,显酸性,H+、Fe2+、NO3-发生氧化还原反应,不能大量共存,故C错误;
D.该组离子之间不反应,可大量共存,故D正确;
故选D.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.下列有关说法不正确的是( )


| A. | 水合铜离子的模型如图1所示,1个水合铜离子中有4个配位键 | |
| B. | CaF2晶体的晶胞如图2所示,Ca2+的配位数与F-的配位数之比为1:2 | |
| C. | 氢原子的电子云图如图3所示,表示一段时间内氢原子核外1个电子在空间出现的概率 | |
| D. | 金属Cu中铜原子堆积模型如图4,该金属晶体为面心立方最密堆积 |
1.某校化学小组学生进行“气体相对分子质量的测定”的实验.操作如下:用质量和容积都相等的烧瓶收集气体,称量收集满气体的烧瓶质量.数据见下表(已换算成标准状况下的数值).
已知标准状况下,烧瓶的容积为0.293L,烧瓶和空气的总质量是48.4212g.空气的平均相对分子质量为29.A、B、C、D、E、F是中学常见的气体.
(1)上述六种气体中,能够使品红溶液褪色的是(写出化学式)SO2.
(2)E的相对分子质量是30.
(3)实验室制取少量D的化学方程式是CaC2+2H2O═Ca(OH)2+C2H2↑.
(4)A、B、C可能的化学式是C2H4、CO、N2.
| 气体 | A | B | C | D | E | F |
| 烧瓶和气体的总质量(g) | 48.4082 | 48.4082 | 48.4082 | 48.3822 | 48.4342 | 48.8762 |
(1)上述六种气体中,能够使品红溶液褪色的是(写出化学式)SO2.
(2)E的相对分子质量是30.
(3)实验室制取少量D的化学方程式是CaC2+2H2O═Ca(OH)2+C2H2↑.
(4)A、B、C可能的化学式是C2H4、CO、N2.
15.下列说法正确的是( )
| A. | 室温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 | |
| B. | 相同温度下,将足量氯化银固体分别加入:①蒸馏水、②0.1 mol•L-1氯化镁溶液、③0.1 mol•L-1盐酸、④0.1 mol•L-1硝酸银溶液中,充分溶解后Ag+浓度:①>③=④>② | |
| C. | 室温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后溶液的pH<7 | |
| D. | 为确定某酸H2A是强酸还是弱酸,可测定室温时NaHA溶液的pH.若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
16.从柑桔中炼制萜二烯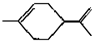 ,下列有关它的推测不正确的是( )
,下列有关它的推测不正确的是( )
 ,下列有关它的推测不正确的是( )
,下列有关它的推测不正确的是( )| A. | 它不能使酸性高锰酸钾溶液褪色 | |
| B. | 常温下为液态,易溶于水 | |
| C. | 分子式为C10H16 | |
| D. | 与过量的溴的CCl4溶液反应后产物为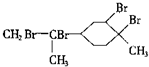 |
