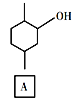
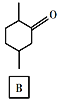
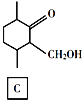
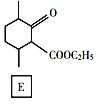
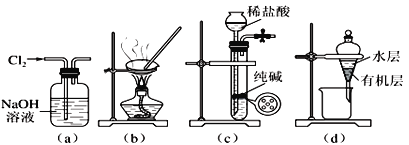
题目内容
【题目】过氧化钠是一种淡黄色固体,有漂白性,能与水、酸性氧化物和酸反应。
(1)一定条件下,m克的H2、CO的混合气体在足量的氧气中充分燃烧,产物与过量的过氧化钠完全反应,过氧化钠固体增重___克。
(2)常温下,将14.0克的Na2O和Na2O2的混合物放入水中,得到400mLpH=14的溶液,则产生的气体标准状况下体积为___L。
(3)在200mLAl2(SO4)3和MgSO4的混合液中,加入一定量的Na2O2充分反应,至沉淀质量不再减少时,测得沉淀质量为5.8克。此时生成标准状况下气体体积为5.6L。则原混合液中c(SO42-)=___mol/L。
(4)取17.88gNaHCO3和Na2O2的固体混合物,在密闭容器中加热到250℃,经充分反应后排出气体,冷却后称得固体质量为15.92g。请列式计算:
①求原混合物中Na2O2的质量B___;
②若要将反应后的固体反应完,需要1mol/L盐酸的体积为多少毫升___?
【答案】m 1.12 2 7.8g 200mL≤V≤320mL
【解析】
(1)利用差量法,根据化学方程式CO与H2在氧气中完全燃烧,生成CO2和H2O,生成的CO2和H2O再与Na2O2反应;2CO+O2![]() 2CO2,一氧化碳与二氧化碳物质的量相等,Na2O2与CO2反应2CO2+2Na2O2=2Na2CO3+O2,质量增重△m为2Na2CO3﹣2Na2O2=2CO,可知,反应后固体质量增加量为CO的质量;2H2+O2
2CO2,一氧化碳与二氧化碳物质的量相等,Na2O2与CO2反应2CO2+2Na2O2=2Na2CO3+O2,质量增重△m为2Na2CO3﹣2Na2O2=2CO,可知,反应后固体质量增加量为CO的质量;2H2+O2![]() 2H2O,生成的水与氢气物质的量相等,Na2O2与H2O反应2H2O+2Na2O2=4NaOH+O2,质量增重△m为2H2O﹣O2=2H2,可知,反应后固体增加的质量为氢气质量;
2H2O,生成的水与氢气物质的量相等,Na2O2与H2O反应2H2O+2Na2O2=4NaOH+O2,质量增重△m为2H2O﹣O2=2H2,可知,反应后固体增加的质量为氢气质量;
(2)氧化钠、过氧化钠与水反应后的溶质为氢氧化钠,根据n=![]() 计算出氢氧化钠的物质的量,再根据质量守恒、钠原子守恒列式计算出氧化钠、过氧化钠的物质的量,最后根据c=
计算出氢氧化钠的物质的量,再根据质量守恒、钠原子守恒列式计算出氧化钠、过氧化钠的物质的量,最后根据c=![]() 计算出氢氧根离子的物质的量、根据过氧化钠与水的反应方程式计算出生成的标况下氧气的体积;
计算出氢氧根离子的物质的量、根据过氧化钠与水的反应方程式计算出生成的标况下氧气的体积;
(3)生成标准状况下气体体积为5.6L,物质的量为:![]() =0.25mol,所以过氧化钠的物质的量为0.5mol,所以氢氧化钠的物质的量为:0.5mol×2=1mol,沉淀质量为5.8克,即氢氧化镁的质量为5.8克,所以氢氧化镁的物质的量为:
=0.25mol,所以过氧化钠的物质的量为0.5mol,所以氢氧化钠的物质的量为:0.5mol×2=1mol,沉淀质量为5.8克,即氢氧化镁的质量为5.8克,所以氢氧化镁的物质的量为:![]() =0.1mol,生成氢氧化镁消耗氢氧根离子的物质的量为0.1×2=0.2mol,则铝离子转化为偏铝酸根离子消耗氢氧根的物质的量为0.8,所以铝离子的物质的量为0.2mol,所以溶液中硫酸根离子的物质的量为:0.3+0.1=0.4mol,则c=
=0.1mol,生成氢氧化镁消耗氢氧根离子的物质的量为0.1×2=0.2mol,则铝离子转化为偏铝酸根离子消耗氢氧根的物质的量为0.8,所以铝离子的物质的量为0.2mol,所以溶液中硫酸根离子的物质的量为:0.3+0.1=0.4mol,则c=![]() =2mol/L;
=2mol/L;
(4)①结合发生的反应2Na2O2+4NaHCO3=4Na2CO3+2H2O↑+O2↑和2Na2O2+2NaHCO3=2Na2CO3+2NaOH+O2↑计算;
②反应后固体为0.08mol的NaOH和0.12mol的Na2CO3,再结合反应原理计算。
(1)CO和H2的混合气体燃烧的方程式:2CO+O2![]() 2CO2,2H2+O2
2CO2,2H2+O2![]() 2H2O,与Na2O2反应的方程式:2CO2+2Na2O2=2Na2CO3+O2,2H2O+2Na2O2=4NaOH+O2,通过方程式可以看出,固体质量的增加量就是原混合气体的质量为mg;
2H2O,与Na2O2反应的方程式:2CO2+2Na2O2=2Na2CO3+O2,2H2O+2Na2O2=4NaOH+O2,通过方程式可以看出,固体质量的增加量就是原混合气体的质量为mg;
(2)设14.0g混合物中含有氧化钠xmol,含有过氧化钠ymol,则①62x+78y=14,最后得到的溶质为NaOH,得到400mL pH=14的溶液,氢氧化钠的物质的量为:0.4×1=0.4mol,根据钠原子守恒可得:②2x+2y=0.4,联合①②解得:x=0.1、y=0.1,所以0.1mol的过氧化钠生成0.05mol的氧气,标况下生成的氧气的体积为:V(O2)=22.4L/mol×0.05mol=1.12L;
(3)生成标准状况下气体体积为5.6L,物质的量为:![]() =0.25mol,所以过氧化钠的物质的量为0.5mol,所以氢氧化钠的物质的量为:0.5mol×2=1mol,沉淀质量为5.8克,即氢氧化镁的质量为5.8克,所以氢氧化镁的物质的量为:
=0.25mol,所以过氧化钠的物质的量为0.5mol,所以氢氧化钠的物质的量为:0.5mol×2=1mol,沉淀质量为5.8克,即氢氧化镁的质量为5.8克,所以氢氧化镁的物质的量为:![]() =0.1mol,生成氢氧化镁消耗氢氧根离子的物质的量为0.1×2=0.2mol,则铝离子转化为偏铝酸根离子消耗氢氧根的物质的量为0.8,所以铝离子的物质的量为0.2mol,所以溶液中硫酸根离子的物质的量为:0.3+0.1=0.4mol,则c=
=0.1mol,生成氢氧化镁消耗氢氧根离子的物质的量为0.1×2=0.2mol,则铝离子转化为偏铝酸根离子消耗氢氧根的物质的量为0.8,所以铝离子的物质的量为0.2mol,所以溶液中硫酸根离子的物质的量为:0.3+0.1=0.4mol,则c=![]() =2mol/L,故答案为:2;
=2mol/L,故答案为:2;
(4)①设Na2O2 和NaHCO3的物质的量分别为x,y;

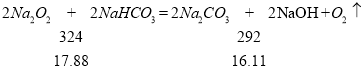
15.41<15.92<16.11 说明两个反应都发生,所以:78x+84y=17.88、106y+(2x﹣y)×40=15.92,解之得:x=0.1mol、y=0.12mol,故m(Na2O2)=7.8g;
②反应后固体为0.08mol的NaOH和0.12mol的Na2CO3,当反应后溶质为NaCl、NaHCO3时,则需盐酸体积为200mL;当反应后溶质只有NaCl时,则需盐酸体积为320mL,故盐酸体积为200mL≤V≤320mL。

【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
下列说法不正确的是
A. I中气体由无色变红棕色的化学方程式:2NO+O2=2NO2
B. II中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C. 对比I、II中现象,说明稀HNO3的氧化性强于浓HNO3
D. 针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化