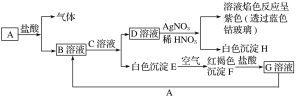
题目内容
【题目】规律提炼题组
完成下列与溶液pH有关的计算,并提炼解题规律。
(1)室温下pH=4的NH4Cl溶液和HCl溶液中由水电离出的c(H+)之比为_______
(2)在25℃时,pH等于9和pH等于11的两种氢氧化钠溶液等体积混合后,溶液中的氢离子浓度为 _____
(3)某温度时,水的KW=10-13,将此温度下pH=12的NaOH溶液aL与pH=2的H2SO4溶液bL混合:,
①若所得混合溶液为中性,则a:b= ____
②若所得混合溶液pH=3,则a:b=_____
(4)已知某温度时0.1 molL-1NaOH pH等于11,在此温度下,若将100体积pH1=a的H2SO4溶液与1体积pH2=b的NaOH溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是________________(用含a、b的表达式表示)
(5)(学法题)总结归纳求混合溶液pH时,应注意的问题:__________________
【答案】 106:1 2×10-11 1:10 9:101 a+b=14 求混合溶液pH时,若混合后溶液呈酸性直接计算氢离子浓度,再求pH,若溶液呈碱性,先计算氢氧根离子浓度,再根据水的离子积计算氢离子浓度,再计算pH
【解析】试题分析:(1)pH=4的NH4Cl溶液和HCl溶液中![]() ,
,![]() ,NH4Cl水解促进水电离,HCl电离出的氢离子抑制水电离;(2)在25℃时,pH等于9和pH等于11的两种氢氧化钠溶液等体积混合后,溶液呈碱性,先计算氢氧根离子浓度,再根据
,NH4Cl水解促进水电离,HCl电离出的氢离子抑制水电离;(2)在25℃时,pH等于9和pH等于11的两种氢氧化钠溶液等体积混合后,溶液呈碱性,先计算氢氧根离子浓度,再根据![]() 计算氢离子浓度; (3)某温度时,水的KW=10-13,此温度下pH=12的NaOH溶液中
计算氢离子浓度; (3)某温度时,水的KW=10-13,此温度下pH=12的NaOH溶液中![]() mol/L, pH=2的H2SO4溶液中
mol/L, pH=2的H2SO4溶液中![]() ;①若所得混合溶液为中性,则n(OH-)=n(H+);②若所得混合溶液pH=3,则反应后剩余氢离子的浓度为
;①若所得混合溶液为中性,则n(OH-)=n(H+);②若所得混合溶液pH=3,则反应后剩余氢离子的浓度为![]() ;(4)已知某温度时0.1 molL-1NaOH pH等于11,在此温度下
;(4)已知某温度时0.1 molL-1NaOH pH等于11,在此温度下![]() , pH1=a的H2SO4溶液溶液中
, pH1=a的H2SO4溶液溶液中![]() 、pH2=b的NaOH溶液中
、pH2=b的NaOH溶液中![]() ,混合后溶液呈中性,则n(OH-)=n(H+);
,混合后溶液呈中性,则n(OH-)=n(H+);
解析:(1)pH=4的NH4Cl溶液和HCl溶液中![]() ,
,![]() ,NH4Cl水解促进水电离,HCl电离出的氢离子抑制水电离;所以NH4Cl溶液中由水电离出的c(H+)=
,NH4Cl水解促进水电离,HCl电离出的氢离子抑制水电离;所以NH4Cl溶液中由水电离出的c(H+)=![]() ,HCl溶液中由水电离出的c(H+)=
,HCl溶液中由水电离出的c(H+)=![]() ,室温下pH=4的NH4Cl溶液和HCl溶液中由水电离出的c(H+)之比为
,室温下pH=4的NH4Cl溶液和HCl溶液中由水电离出的c(H+)之比为![]() 106:1 ;
106:1 ;
(2)在25℃时,pH等于9和pH等于11的两种氢氧化钠溶液等体积混合后,![]() ,
,![]() ;
;
(3)①若所得混合溶液为中性,则![]() ,即
,即![]() ,所以a:b=1:10;②若所得混合溶液pH=3,则反应后剩余氢离子的浓度为
,所以a:b=1:10;②若所得混合溶液pH=3,则反应后剩余氢离子的浓度为![]() ,则a:b=9:101;
,则a:b=9:101;
(4)已知某温度时0.1 molL-1NaOH pH等于11,在此温度下![]() , pH1=a的H2SO4溶液溶液中
, pH1=a的H2SO4溶液溶液中![]() 、pH2=b的NaOH溶液中
、pH2=b的NaOH溶液中![]() ,混合后溶液呈中性,则
,混合后溶液呈中性,则![]() ;a+b=14;
;a+b=14;
(5)求混合溶液的pH时,若混合后溶液呈酸性直接计算氢离子浓度,再求pH,若溶液呈碱性,先计算氢氧根离子浓度,再根据水的离子积计算氢离子浓度,再计算pH。

 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案