题目内容
【题目】在体积恒定的密闭容器中,一定量的二氧化硫与1.100mol氧气在催化剂作用下加热到600℃发生反应:2SO2+O2![]() 2SO3。当气体的物质的量减少0.315mol时反应达到平衡,在相同温度下测得气体压强为反应前的82.5%。下列有关叙述正确的是( )
2SO3。当气体的物质的量减少0.315mol时反应达到平衡,在相同温度下测得气体压强为反应前的82.5%。下列有关叙述正确的是( )
A. 三氧化硫生成的速率与二氧化硫消耗的速率相等时反应达到平衡
B. 降低温度,正反应速率减小,逆反应速率增大
C. 平衡混合气体通入过量氯化钡溶液中,得到沉淀的质量为161.980g
D. 达到平衡时,二氧化硫的转化率为90%
【答案】D
【解析】
A.SO3的生成速率与SO2的消耗速率都是正反应速率,两者始终相等,不能作为判断化学平衡的依据,故A错误;
B.降低温度,正反应速率和逆反应速率都减小,故B错误;
C.设二氧化硫起始物质的量是xmol,平衡时转化的二氧化硫为ymol,则:
2SO2(g)+O2(g)![]() 2SO3(g)
2SO3(g)
起始量(mol): x 1.100 0
转化量(mol): y 0.5y y
平衡量(mol): x-y 1.100-0.5y y
气体总物质的量减少0.315mol时反应达到平衡,则0.5y=0.315,故y=0.63,在相同的温度下测得气体压强为反应前的82.5%,则![]() ×100%=82.5%,故x=0.7。将混合气体通入过量的氯化钡溶液中,三氧化硫和氯化钡溶液反应生成硫酸钡沉淀,二氧化硫与氧气、水反应生成硫酸,硫酸与氯化钡反应生成硫酸钡沉淀,0.7mol二氧化硫完全转化消耗0.35mol氧气,氧气有剩余,根据硫元素守恒,硫酸钡的物质的量是0.7mol,故其质量为0.7mol×233g/mol=163.1g,故C错误;
×100%=82.5%,故x=0.7。将混合气体通入过量的氯化钡溶液中,三氧化硫和氯化钡溶液反应生成硫酸钡沉淀,二氧化硫与氧气、水反应生成硫酸,硫酸与氯化钡反应生成硫酸钡沉淀,0.7mol二氧化硫完全转化消耗0.35mol氧气,氧气有剩余,根据硫元素守恒,硫酸钡的物质的量是0.7mol,故其质量为0.7mol×233g/mol=163.1g,故C错误;
D.达到平衡时,SO2的转化率=![]() ×100%=90%,故D正确。
×100%=90%,故D正确。
故选D。

 科学实验活动册系列答案
科学实验活动册系列答案【题目】某小组同学通过“FeSO4被HNO3氧化”的实验,验证Fe2+的还原性。
实验一:验证Fe2+的还原性
实验操作 | 预测现象 | 实验现象 |
向盛有2mLFeSO4溶液的试管中,滴入几滴浓硝酸,振荡 | 试管中产生红棕色气体,溶液变为黄色 | 试管中产生红棕色气体, 溶液变为深棕色 |
(1)红棕色气体是______________ (填化学式);
(2)实验现象与预期不符,继续进行实验。取深棕色溶液于试管中,滴加KSCN溶液,溶液变为血红色,该现象说明____________。
实验二:探究溶液变为深棕色的原因
〔资料与猜想〕查阅资料后猜想,可能是生成的NO2或者NO与溶液中的Fe2+或Fe3+反应,而使溶液变为深棕色。
〔实验与探究〕用下图所示装置进行实验,步骤及现象如下:(装置的气密性已检验,尾气处理已略去)
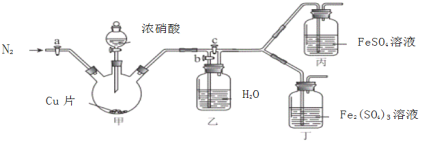
ⅰ关闭c,打开a和b,通入N2,一段时间后关闭a;
ⅱ向甲中加入适量浓HNO3,一段时间后丙中溶液变为深棕色,丁中溶液无明显变化;
ⅲ关闭b,打开c,更换丙、丁中的溶液(试剂不变);
ⅳ继续向甲中加入浓HNO3,一段时间后观察到了与ⅱ相同的实验现象。
根据以上实验步骤和实验现象回答下列问题:
(3)通入N2的目的是______________;
(4)铜与浓硝酸反应的化学方程式是_______________;
(5)装置乙的作用是_________________;
(6)实验结论是____________。