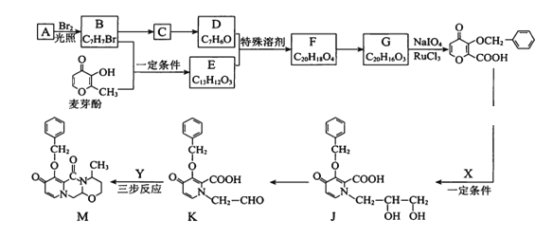
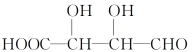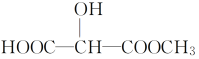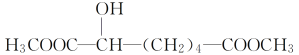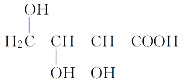题目内容
【题目】已知酸性: ![]() >H2CO3>
>H2CO3>![]() >HCO3-;现要将
>HCO3-;现要将![]() 转变为
转变为 ![]() ,可行的方法是
,可行的方法是
A.向该溶液中加入足量的稀硫酸,加热
B.将该物质与稀硫酸共热后,再加入足量的NaOH溶液
C.将该物质与足量的NaOH溶液共热,再通入足量CO2气体
D.将该物质与稀硫酸共热后,再加入足量的Na2CO3溶液
【答案】C
【解析】
已知酸性:![]() >H2CO3>
>H2CO3>![]() >HCO3-,将
>HCO3-,将 ![]() 转变为
转变为 ![]() ,则先发生水解反应,然后加入的物质与-COOH反应而不与-OH反应,据此分析。
,则先发生水解反应,然后加入的物质与-COOH反应而不与-OH反应,据此分析。
A.![]() 在酸性条件下水解生成
在酸性条件下水解生成![]() ,故A错误;
,故A错误;
B.![]() 在酸性条件下水解生成
在酸性条件下水解生成![]() ,再加入足量的NaOH溶液,-COOH和-OH均与NaOH溶液反应,故B错误;
,再加入足量的NaOH溶液,-COOH和-OH均与NaOH溶液反应,故B错误;
C.![]() 与足量的NaOH溶液共热,再通入足量CO2气体,生成
与足量的NaOH溶液共热,再通入足量CO2气体,生成![]() ,故C正确;
,故C正确;
D.![]() 在酸性条件下水解生成
在酸性条件下水解生成![]() ,再加入足量的Na2CO3溶液生成
,再加入足量的Na2CO3溶液生成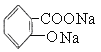 ,故D错误;
,故D错误;
故答案为C。

练习册系列答案
相关题目