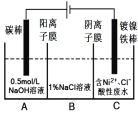
题目内容
【题目】根据下列实验操作和现象得出的相关结论正确的是

A. A B. B C. C D. D
【答案】A
【解析】氯乙烷在氢氧化钠水溶液中水解为乙醇和氯化钠,氯化钠与硝酸银反应生成难溶于硝酸的氯化银沉淀,故A正确;Fe(NO3)2溶液加入稀硫酸,Fe2+可以被硝酸氧化为Fe3+,所以Fe(NO3)2溶液加入稀硫酸,在加KSCN溶液,溶液变成血红色,不能证明Fe(NO3)2已变质,故B错误;若盐酸的浓度不同,相同温度下,将等质量的大理石块和大理石粉加入到等体积的盐酸中,反应速率:大理石粉不一定大理石块,故C错误;2mL0.01mol/L的Na2S溶液中滴入几滴ZnSO4,Na2S溶液有剩余,再滴入几滴CuSO4溶液,Na2S与CuSO4反应生成CuS沉淀,不能证明![]() ,故D错误。
,故D错误。

【题目】利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。
(1)T1℃时,在2L密闭容器中充入0.6molSO3,图1表示SO3物质的量随时间的变化曲线。

①平衡时,SO3的转化率为______(保留一位小数);在T1℃下反应2SO2(g)+O2(g) ![]() 2SO3(g) 的平衡常数为____________;若其他条件不变,在8min时压缩容器的体积至1L,则n(SO3)的变化曲线为_______(填字母)。
2SO3(g) 的平衡常数为____________;若其他条件不变,在8min时压缩容器的体积至1L,则n(SO3)的变化曲线为_______(填字母)。
②下表为不同温度(T)下反应2SO2(g)+O2(g) ![]() 2SO3(g) △H<0的化学平衡常数(K):
2SO3(g) △H<0的化学平衡常数(K):
T/℃ | T2 | T3 |
K | 20.5 | 4.68 |
由此推知,其他条件相同,在T1、T2、T3三种不同温度下,反应从开始至达到平衡时所需要的时间最长的是 _____________。(填“T1”、“T2”或“T3”)
(2)在体系恒压的条件下进行反应:2SO2(g)+O2(g) ![]() 2SO3(g),原料气中SO2和O2的物质的量之比(k)不同时,SO2的平衡转化率与温度(t)的关系如图2所示:图中k1、k2、k3的大小顺序为____________。
2SO3(g),原料气中SO2和O2的物质的量之比(k)不同时,SO2的平衡转化率与温度(t)的关系如图2所示:图中k1、k2、k3的大小顺序为____________。